题目内容
【题目】粗盐中除了含有NaC1外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。同学们为了得到更纯的NaCl,设计了如下实验方案
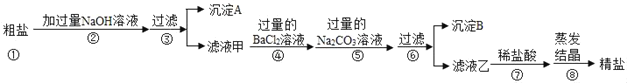
请回答下列问题
(1)请写出步骤②发生反应的化学方程式_____。
(2)若将步骤④和⑤顺序顺倒会引发的后果是_____。
(3)沉淀B中除了含有CaCO3以外还含有_____;(填化学式)
(4)滤液乙中含有的阴离子是_____。(填离子符号)
【答案】![]() 过量的氯化钡不能除去 BaSO4、BaCO3 Cl﹣、OH﹣、CO32﹣
过量的氯化钡不能除去 BaSO4、BaCO3 Cl﹣、OH﹣、CO32﹣
【解析】
(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠;故填:![]() ;
;
(2)若将步骤④和⑤顺序颠倒会引发的后果是过量的氯化钡不能除去。故填:过量的氯化钡不能除去;
(3)滤液甲中为CaCl2、Na2SO4、NaC1,加入过量的氯化钡溶液,氯化钡与硫酸钠反应生成硫酸钡沉淀,再加入过量的碳酸钠溶液,由于氯化钡溶液过量,所以碳酸钠与氯化钡反应生成碳酸钡沉淀,碳酸钠与氯化钙反应生成碳酸钙沉淀,所以沉淀B中除了含有CaCO3以外还含有BaSO4、BaCO3.故填:BaSO4、BaCO3。
(4)由于氢氧化钠和碳酸钠都过量,所以滤液乙中含有的阴离子:氯化钠中的氯离子,氢氧化钠中的氢氧根离子,碳酸钠中的碳酸根离子。故填:Cl﹣、OH﹣、CO32﹣。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目