题目内容
【题目】以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图。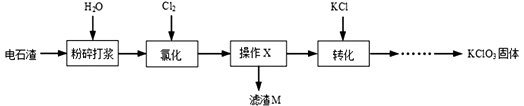
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6 Ca(OH)2 + 6 Cl2 = Ca(ClO3)2 + 5CaCl2 + aH2O
(1)氯化前,先将电石渣粉碎的目的是。
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为价,a数值为
(3)操作X为。转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为。(相关物质的溶解度见下图)
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③。
【实验验证】
实验步骤 | 实验现象 | 结论 |
步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入; | 观察到现象 | 猜想①不正确 |
步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到现象 | 猜想③正确 |
【答案】
(1)增大反应物的接触面积,使反应更快更充分
(2)+5,6
(3)过滤,Ca(ClO3) 2+2KCl=CaCl2+2KClO3↓
(4)Ca(OH) 2和CaCO3,加入酚酞(或CuSO4溶液、FeCl3溶液),变红(或产生蓝色沉淀、红褐色沉淀)(合理即可),有气泡产生
【解析】电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3;(1)将电石渣粉碎可以增大反应物与水的接触面积,使反应更快更充分;(2)氯酸钙Ca(ClO3)2中Ca元素化合价为+2价,氧元素化合价为-2价,根据化合物中各元素正负化合价的代数和为0,计算出Cl的化合价为+5价,化学反应前后原子种类和数目均不发生改变,根据氢原子守恒可知6×2=a×2,则a=6;(3)操作的目的为除去溶液中不溶性的杂质,应为过滤;根据KClO3、CaCl2、Ca(ClO3)2、KCl四种物质的溶解度,Ca(ClO3)2与KCl发生复分解反应生成KClO3的化学方程式为Ca(ClO3) 2+2KCl=CaCl2+2KClO3↓;(4)【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2的混合物;
【实验验证】
步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先滴加酚酞,溶液变红,说明溶液显碱性,滤渣中一定含有Ca(OH)2,则猜想①不正确;
步骤2:向小烧杯中继续加入足量的稀盐酸,观察到有气泡产生,说明有碳酸钙存在,则滤渣中有Ca(OH)2和碳酸钙,故猜想③正确。
根据化合价的计算方法分析,在化合物中,各元素化合价代数和为0;根据方程式的书写方法分析,书写方程式时先找出反应物、生成物,并写出化学式分别放在等号左右两边,然后再配平,标注条件;根据反应物物质成分探究方法分析,反应后的物质成分进行探究时除要考虑生成物外还要考虑反应物是否有剩余。

 阅读快车系列答案
阅读快车系列答案