题目内容
氢氧化钠(NaOH)和氢氧化钙[Ca(OH)2]是常见的碱,在现实生活中有广泛的用途.根据所学知识回答:(1)将氢氧化钠和氢氧化钙暴露在空气中都会变质生成某一类盐,该类盐的阴离子符号是______.
(2)实验室常用澄清的石灰水来检验二氧化碳,将饱和的石灰水溶液升高温度,溶液浓度将______(填“增大”、“减小”或“不变”).
(3)长期不合理使用化肥(例如使用硫酸铵)会使土壤酸化(含有硫酸),熟石灰常用来改良酸性土壤,反应的化学方程式是______.
(4)农业生产中常用氢氧化钙和硫酸铜配置波尔多液来防治果树的霉叶病等,配制波尔多液时______(填“能”或“不能”)用铁制容器.
(5)氢氧化钠常用来干燥某些气体,其干燥原理是______.
【答案】分析:(1)根据氢氧化钠、氢氧化钙易与二氧化碳反应生成碳酸盐的组成分析
(2)根据氢氧化钙的溶解度受温度的变化分析
(3)根据书写方程式原则分析
(4)根据铁与硫酸铜能反应分析
(5)根据氢氧化钠的吸水性分析
解答:解:(1)氢氧化钠和氢氧化钙暴露在空气中易与二氧化碳反应分别生成碳酸钠、碳酸钙,它们共同的阴离子是碳酸根离子,符号为CO32-
(2)氢氧化钙的溶解度随温度升高而减小,故将饱和石灰水升高温度,氢氧化钙析出,溶液浓度减小
(3)氢氧化钙与硫酸发生中和反应生成硫酸钙和水,化学方程式为Ca(OH)2+H2SO4═CaSO4↓+2H2O
(4)铁与硫酸铜反应生成铜和硫酸亚铁,能腐蚀铁制容器,故配制波尔多液时不能用铁制容器
(5)氢氧化钠易吸收水而潮解,故氢氧化钠可用某些气体的干燥剂
故答案为:(1)CO32-(2)减小(3)Ca(OH)2+H2SO4═CaSO4↓+2H2O(4)不能(5)氢氧化钠易吸收水分
点评:本题考查常见碱的性质与用途,性质决定用途,用途反过来反映性质.
(2)根据氢氧化钙的溶解度受温度的变化分析
(3)根据书写方程式原则分析
(4)根据铁与硫酸铜能反应分析
(5)根据氢氧化钠的吸水性分析
解答:解:(1)氢氧化钠和氢氧化钙暴露在空气中易与二氧化碳反应分别生成碳酸钠、碳酸钙,它们共同的阴离子是碳酸根离子,符号为CO32-
(2)氢氧化钙的溶解度随温度升高而减小,故将饱和石灰水升高温度,氢氧化钙析出,溶液浓度减小
(3)氢氧化钙与硫酸发生中和反应生成硫酸钙和水,化学方程式为Ca(OH)2+H2SO4═CaSO4↓+2H2O
(4)铁与硫酸铜反应生成铜和硫酸亚铁,能腐蚀铁制容器,故配制波尔多液时不能用铁制容器
(5)氢氧化钠易吸收水而潮解,故氢氧化钠可用某些气体的干燥剂
故答案为:(1)CO32-(2)减小(3)Ca(OH)2+H2SO4═CaSO4↓+2H2O(4)不能(5)氢氧化钠易吸收水分
点评:本题考查常见碱的性质与用途,性质决定用途,用途反过来反映性质.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
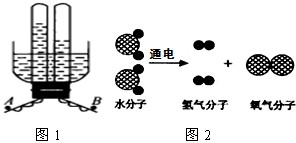 如图1是某同学自己设计的装置:用大塑料瓶子截去瓶底,留瓶口一段约8cm~10cm,瓶口配一胶塞由里往外塞紧.A、B两极是用镀铬曲别针伸直做成,由塞子露头处连接导线.试回答:
如图1是某同学自己设计的装置:用大塑料瓶子截去瓶底,留瓶口一段约8cm~10cm,瓶口配一胶塞由里往外塞紧.A、B两极是用镀铬曲别针伸直做成,由塞子露头处连接导线.试回答: