题目内容
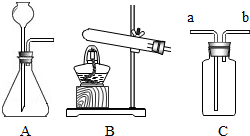 硫化氢(H2S)是一种具有臭鸡蛋气味的有毒气体,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性.实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeSO4.
硫化氢(H2S)是一种具有臭鸡蛋气味的有毒气体,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性.实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeSO4.(1)在如图中,应选用图
(2)收集H2S气体时,应从C装置中的
(3)实验室若制取6.8克的硫化氢气体,理论上需要多少克20%的硫酸溶液?
考点:常用气体的发生装置和收集装置与选取方法,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见气体的实验室制法、检验、干燥与净化
分析:(1)据实验室用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,选择制取装置,据实验室制取二氧化碳的反应原理写出方程式;
(2)根据气体的物理性质可以选择收集方法;
(3)根据反应的化学方程式、硫化氢的质量可以计算20%的硫酸溶液的质量.
(2)根据气体的物理性质可以选择收集方法;
(3)根据反应的化学方程式、硫化氢的质量可以计算20%的硫酸溶液的质量.
解答:解:(1)据实验室用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,选择制取装置A;实验室可用A装置制取二氧化碳气体,该反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)硫化氢能够溶于水,不能用排水法收集,硫化氢的密度比空气大,可以用向上排空气法收集,用C装置收集硫化氢时,应从C装置中的a导管进入;
因为硫化氢溶于水形成氢硫酸,氢硫酸具有酸的通性,可以用碱性溶液吸收硫化氢,例如可以用氢氧化钠溶液、氢氧化钾溶液等吸收.
故答案为:a;用氢氧化钠溶液吸收.
(3)解:设需要20%硫酸溶液的质量为X,
H2S04+FeS=H2S↑++FeS04
98 34
20%X 6.8克
=
X=98克;
答:需要20%硫酸溶液的质量为98克.
故答案为:(1)A,CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)a,用碱溶液吸收;
(3)解:设需要20%硫酸溶液的质量为X
H2SO4+FeS=H2S↑+FeSO4
98 34
20%X 6.8克
=
X=98克
答,需要20%硫酸溶液质量为98克
(2)硫化氢能够溶于水,不能用排水法收集,硫化氢的密度比空气大,可以用向上排空气法收集,用C装置收集硫化氢时,应从C装置中的a导管进入;
因为硫化氢溶于水形成氢硫酸,氢硫酸具有酸的通性,可以用碱性溶液吸收硫化氢,例如可以用氢氧化钠溶液、氢氧化钾溶液等吸收.
故答案为:a;用氢氧化钠溶液吸收.
(3)解:设需要20%硫酸溶液的质量为X,
H2S04+FeS=H2S↑++FeS04
98 34
20%X 6.8克
| 98 |
| 20%X |
| 34 |
| 6.8克 |
X=98克;
答:需要20%硫酸溶液的质量为98克.
故答案为:(1)A,CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)a,用碱溶液吸收;
(3)解:设需要20%硫酸溶液的质量为X
H2SO4+FeS=H2S↑+FeSO4
98 34
20%X 6.8克
| 98 |
| 20%X |
| 34 |
| 6.8克 |
X=98克
答,需要20%硫酸溶液质量为98克
点评:本题考查装置的选择、根据化学方程式计算,比较简单,计算时要注意规范性和准确性.

练习册系列答案
相关题目
在下列各种碳单质的用途中,利用其化学性质的是( )
| A、石墨用作电极 |
| B、焦炭用于金属的冶炼 |
| C、活性炭用于某些气体或液体的净化 |
| D、炭黑用于制造油墨、鞋油和颜料 |
