题目内容
【题目】黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4 , 利用如图实验可制取补血剂原料碳酸亚铁并回收铜。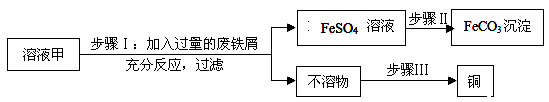
(1)步骤Ⅰ中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe ![]() 3FeSO4;
3FeSO4;
②;
③。
(2)步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是(填化学式)。
(3)步骤Ⅲ回收铜的实验操作包括:①过滤、②洗涤、③加足量稀硫酸、④干燥,正确的操作排序是(填序号)。
(4)若废铁屑含有少量铁锈,对达成实验目的(填“有”或“无”)影响。
(5)查资料可知,Fe2+在空气中可氧化成Fe3+ , 为防止FeSO4溶液在空气中氧化,可在溶液中加入少量。
【答案】
(1)Fe+H2SO4=FeSO4+H2↑,Fe+CuSO4=Cu+FeSO4
(2)Na2CO3/K2CO3
(3)③①②④
(4)无
(5)铁粉
【解析】(1)Fe2(SO4)3、CuSO4及H2SO4都能与铁反应,反应的方程式为:Fe+H2SO4=FeSO4+H2↑; Fe+CuSO4=FeSO4+Cu;(2)步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是Na2CO3,碳酸钠与硫酸亚铁反应生成碳酸亚铁沉淀;(3)步骤Ⅲ回收铜的实验操作因不溶物中含有铜和铁,先加足量稀硫酸,与铁反应,然后过滤则不容的部分为铜,再经过洗涤、干燥得到铜;(4)溶液中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;(5)FeSO4被氧化而变质,应加入具有还原性的物质,且溶液配制中不能引入新的杂质,所以加入少量的铁粉。
【考点精析】关于本题考查的金属材料的选择依据和书写化学方程式、文字表达式、电离方程式,需要了解黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号才能得出正确答案.

【题目】下列有关物质的性质与用途具有对应关系的是( )
A.石墨具有导电性,可用于制铅笔芯
B.N2的化学性质不活泼,可用作保护气
C.NaCl溶液有咸味,可用于配制生理盐水
D.干冰升华吸热,可用于食品干燥
【题目】鉴别物质的方法或试剂正确的是
选项 | 待鉴别的物质 | 所选试剂或方法 |
A | 氮气和二氧化碳 | 燃烧的木条 |
B | 二氧化锰和氧化铜 | 观察颜色 |
C | 水和双氧水 | 二氧化锰 |
D | 氢氧化钠溶液和碳酸钠溶液 | 无色酚酞试液 |
A.AB.BC.CD.D
【题目】“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56 g)
实验员 | 甲 | 乙 | 丙 |
烧杯+稀盐酸质量 | 139 g | 129 g | 129 g |
加入黄铜样品质量 | 20 g | 24 g | 20 g |
充分反应后,烧杯+剩余物质质量 | 158.8 g | 152.8 g | 148.8 g |
请回答下列问题:
(1)_____同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是_______。
(2)计算黄铜样品中锌的质量分数是__________。
(3)完全反应后,所得溶液的溶质质量分数是___________。

