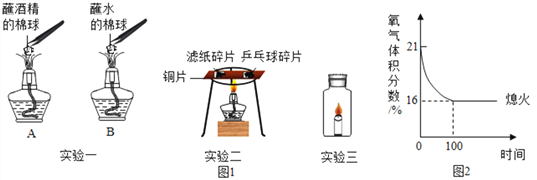
题目内容
【题目】实验小组用下图装置进行实验。
已知:甲瓶中充满二氧化碳,乙中液体是水,实验前K关闭。
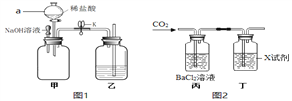
(1)图1装置甲中仪器a的名称____________;
(2)将装置甲中胶头滴管中的浓NaOH溶液挤入瓶中,振荡;打开装置甲中K,观察到乙中的现象是_____,原因是________;接着将装置甲仪器a中的稀盐酸注入甲中,观察到甲中有气泡产生,该反应的化学方程式为________。观察到乙中的现象是____________;
(3)为了充分证明二氧化碳与氢氧化钠能发生反应,某同学设计了图2所示的实验方案,则装置丁中X试剂含有的溶质为______和______(填化学式),装置丙的作用是______;
(4)实验过程中需配制100 g30%的NaOH溶液,需要水的质量是________ g。配制时需要用到的仪器 ____________。(填写字母)
A.托盘天平 B.胶头滴管 C.漏斗 D.量筒
【答案】 分液漏斗 导管口有气泡冒出 甲中二氧化碳被消耗,导致瓶内压强减小,空气进入乙瓶中 Na2CO3+2HCl== 2NaCl + CO2↑+ H2O (或NaHCO3+HCl== NaCl + CO2↑+ H2O) 长玻璃管内液面上升 NaOH BaCl2 证明二氧化碳与氯化钡不能发生反应(或作对比) 70 ABD
【解析】(1)根据常见仪器解答;(2)根据氢氧化钠溶液与二氧化碳反应使甲内压强降低解答;根据碳酸钠(碳酸氢钠)与稀盐酸反应生成氯化钠、水和二氧化碳解答;根据有气体产生,导致装置内压强增大解答;(3)根据对比实验分析解答;(4)根据溶液的配制计算解答。(1)图1装置甲中仪器a的名称为分液漏斗;(2)将装置甲中胶头滴管中的浓NaOH溶液挤入瓶中,振荡,氢氧化钠与二氧化碳反应生成碳酸钠和水;打开装置甲中K,观察到乙中的现象是导管口有气泡冒出,原因是甲中二氧化碳被消耗,导致瓶内压强减小,空气进入乙瓶中;接着将装置甲仪器a中的稀盐酸注入甲中,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,该反应的化学方程式为Na2CO3+2HCl=2NaCl + CO2↑+ H2O。观察到乙中的现象是长玻璃管内液面上升;(3)为了充分证明二氧化碳与氢氧化钠能发生反应,某同学设计了图2所示的实验方案,则装置丁中X试剂含有的溶质为NaOH和BaCl2,装置丙的作用是证明二氧化碳与氯化钡不能发生反应(或作对比);(4)实验过程中需配制100 g30%的NaOH溶液,需要水的质量=100g-(100g×30%)=70g;配制时需要用托盘天平进行称量物质的质量,用量筒和胶头滴管量取液体的体积,故选ABD。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某研究性学习小组在验证“碱溶液使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴人某NaOH溶液中,溶液变成了红色,可是过一会儿红色却又消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
1.将NaOH溶液加热煮沸 | _________ | 溶液变红,过一会儿红色消失 | 甲同学猜想不正确 |
2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方 | _______ |
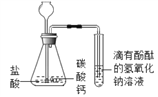
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式:_____。甲同学认为乙同学的实验不够严谨,理由是_____。
(3)请设计一个实验方案证明丙同学的猜想正确。___________(写出操作方案和现象)。
【题目】科学方法对化学学习起着事半功倍的作用。
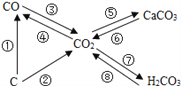
(1)分类归纳是研究化学物质的重要方法。如图是某同学整理的碳及其化合物的知识网络图,转化③常用于冶炼工业,工业上用赤铁矿炼铁时,反应的化学方程式为_____________,二氧化碳使紫色石蕊试液变红涉及的反应是如图所示转化中_______(填序号)。
(2)微观粒子模型化是研究化学变化的重要方法。
①下图是钠与氯气反应生成氯化钠的示意图。该图说明在化学反应过程中一定发生变化的是__________(填字母)。
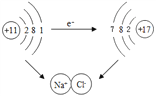
A.原子核 B.原子核最外层电子数 C.原子的电子层数
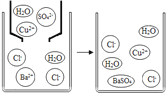
②下图是硫酸铜溶液与氯化钡溶液反应示意图。从粒子角度分析该化学反应能发生的原因是___________________________。
③A、B、C、D表示4种物质,下图是部分物质的微观示意图。A和B在一定条件下反应生成C和D。
物质 | B | C | D |
|
微观示意图 |
|
|
|
若一定质量的A和4.8g B恰好完全反应,可生成4.4gC和2.7gD,则A的化学式是____。
④我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破。甲烷转化反应的微观示意图如下:

图示所表示的反应的化学方程式为___________________。
(3)控制变量、设计对比实验是实验探究的重要方法。
下图实验是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。下列结论不正确的是__(填字母)。
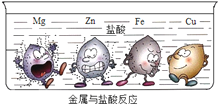
A.铜不能发生置换反应
B.四种金属中金属活动性最强的是Mg
C.等质量的锌和铁分别与足量的盐酸反应生成气体质量:Zn比Fe多