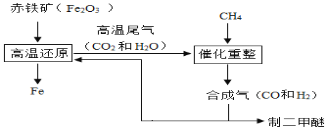
题目内容
【题目】硫酸铁铵[NH4Fe(SO4)2xH2O]是一种重要铁盐,能在水中解离出NH4+、Fe3+、SO42-。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流 程如下:
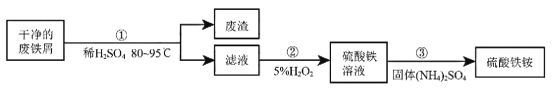
回答下列问题:
(1)步骤①发生反应的方程式是_____________。经检验,废渣是片状石墨,它与金刚石的物理性质有很大差异的原因是___________________。
(2)完成步骤②中的反应2FeSO4+H2O2+____________=Fe2(SO4)3+ 2H2O
(3)如废铁屑表面已生锈(铁锈的主要成分为Fe2O3xH2O),则步骤①还会发生另外两步反应:
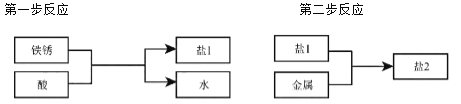
第二步反应中反应物与生成物的化学计量数之比为1:1:3,写出第二步反应的化学方程式: _____ 。
(4)由该实验可知,干净的表面未生锈的废铁屑属于________ (填“纯净物”或“混合物”)。
(5)将步骤③中得到的样品经干燥后加热,失掉全部结晶水,剩余固体的质量为原晶体质量的55.2%,则硫酸铁铵晶体的化学式为_______ (填序号)。
a. NH4Fe(SO4)23H2O
b. NH4FeSO4)6 H2O
c. NH4Fe(SO4)29 H2O
d. NH4FeSO4)12 H2O
(6)完成鉴别硫酸铁和硫酸铁铵两种固体的实验报告。
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |
【答案】![]() 原子排列方式不同
原子排列方式不同 ![]()
![]() 混合物 d 取两种固体加入A、B两支试管内,加水溶解,然后分别加入足量氢氧化钠溶液 A试管有气泡产生,B试管无气泡产生 A试管内为硫酸铁铵,B试管内为硫酸铁
混合物 d 取两种固体加入A、B两支试管内,加水溶解,然后分别加入足量氢氧化钠溶液 A试管有气泡产生,B试管无气泡产生 A试管内为硫酸铁铵,B试管内为硫酸铁
【解析】
(1)铁与稀硫酸反应生成硫酸亚铁和氢气,反应的方程式是![]() ;金刚石与石墨都是有碳原子组成,但是原子排列方式不同,造成两者性质不同;
;金刚石与石墨都是有碳原子组成,但是原子排列方式不同,造成两者性质不同;
(2)根据反应后原子数目与种类,与反应前原子数目与种类进行对比,得出反应前缺少2个氢原子,1个硫原子和4个氧原子,由此可以看出反应前为1个硫酸分子;
故填:![]() ;
;
(3)盐1和金属反应生成盐2,发生化合反应,盐1为硫酸铁,可与铁反应生成硫酸亚铁,反应方程式配平后系数比为1:1:3,反应的化学方程式为![]() ;
;
(4)有实验可知含有铁和不溶于酸的杂质组成,因此属于混合物;
(5)根据反应前后质量变化,设含有结晶水系数为x,失去水的质量占原晶体质量为44.8%,所以![]() ,x=12;
,x=12;
故填:d。
(6)硫酸铁铵含有铵根离子,铵根与氢氧根反应生成氨气,形成气泡,所以根据产生气泡判断固体为硫酸铁铵,无气泡的则为硫酸铁;故有:
实验步骤 | 实验现象 | 实验结论 |
取两种固体加入A、B两支试管内,加水溶解,然后分别加入足量氢氧化钠溶液 | A试管有气泡产生,B试管无气泡产生 | A试管内为硫酸铁铵,B试管内为硫酸铁 |

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%~5%的醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是____________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为_____________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式________________。
(3)某同学对白醋的性质进行如下探究。
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入______ | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | __________________ | 白醋能与活泼金属反应 |
③将白醋滴加到碳酸钙表面 | 有少量气泡产生 | 反应的化学方程式是_________ |
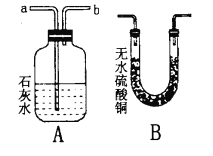
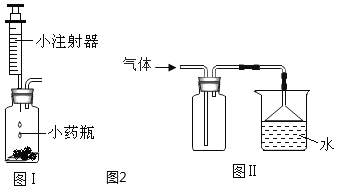
(4)若用如图装置验证水和二氧化碳两种气体生成物,应将生成的混合气体先通过_________装置,反之会有何影响?_______________。若将气体通入装置A进行验证时,气流应从_______________口通入。