��Ŀ����
����Ŀ��ʵ������һƿ���ڷ��õ��������ƹ��壬ij��ѧ��ȤС���ͬѧ�Ըù���ı����������̽����
��������⣩
��ƿ�������ƹ����Ƿ���ʣ����������Σ�
���������ϣ�
�����������ڿ��������ױ��ʵ�����ת��ΪNaHCO3��
��CaCl2��Һ�����ԡ�
��������룩
����I������δ���ʣ�
������岿�ֱ��ʣ�
���ϲ����Ƿ��Ͻ�����˵������________��
������ʵ�飩
С��ͬѧȡ������Ʒ���ձ��У�������ˮ�ܽ⣬������Һ�е��뼸�η�̪��Һ����Һ��죬�ɴ����ó�����I��ȷ��������ͬѧ�ܿ����Է�������__________��
Ϊ�˽�һ���ó����ۣ�����������λͬѧ�ֱ�ȡС��ʵ������Һ���Թ��У���������ʵ�飺
С�� | С�� | Сɳ | |
ʵ����� | ������������������Һ | ��������Ȼ�����Һ | �������ϡ���� |
��ʵ����ۣ�
��1��С�졢С����ʵ���ж��۲쵽��____________���������Ƕ��ó��������ȷ��
��2����ʦָ������ƾС���ʵ�������������ȷ������������������_________��
��3������С����ʵ������Ʋ�Сɳ��ʵ������Ϊ_________��
����չ������
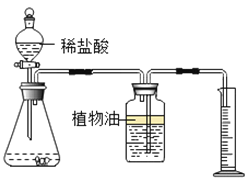
��βⶨ���ʵ��������ƹ�����̼���Ƶ�����������
�������ۣ�С��ͬѧ��ȡһ����������Ʒ��������ͼ��ʾװ�ý���ʵ�飬��ͨ���������ɶ�����̼����������̼���Ƶ�����������������̼�ܶ���֪������ʵ���У���û�м���ֲ���ͣ��ⶨ�Ľ����__________��ѡ����ƫ��������ƫС����������������
���𰸡����Ͻ�����������Ҳ����ȫ������ ̼������ҺҲ�Լ��ԣ�Ҳ��ʹ��ɫ��̪��Һ��� ��ɫ�������ɣ���Һ�Ժ�ɫ ��������������Һ���ԭ��Һ���������Ƶļ�����ɸ��ţ��������ɣ� �տ�ʼ����������һ��ʱ��������ݲ���������Һ��ɫ���ɺ�ɫ��Ϊ��ɫ ƫС
��������
[�������]
���ڷ��õ��������ƹ������û�б��ʣ����ܲ��ֱ��ʣ�Ҳ������ȫ�����ʡ�
[����ʵ��]
��������������Һ��̼������Һ���ʼ��ԣ�����ʹ��ɫ��̪��Һ��죬����ȡ����Ʒ����ˮ�μ���ɫ��̪��Һ�����жϳ�������������Ʒ�Ƿ���ʡ�
[ʵ�����]
��1���������ǵó��Ľ����Dz������ȷ����֪�������Ʋ��ֱ��ʣ����Ը���Ʒ�к����������ƺ�̼�����������ʣ�����Ʒ��Һ�еμ�����������Һ���Ȼ�����Һ����������̼��ư�ɫ������ͬʱ��Һ�к����������ƣ���Һ�ʺ�ɫ��
��2����������������Һ�Լ�������̼���Ʒ�Ӧ���������������ɣ���������Ʒ��Һ�еμ�����������Һ����������ֻ��ȷ����Ʒ�к���̼���ƣ�����ȷ����Ʒ���Ƿ����������ơ�
��3����С���ó��Ľ��۸�����������Ʒ���ֱ��ʣ������еμ�ϡ����ʱ��ϡ���������������Ʒ�Ӧ��������������ȫ��Ӧ������̼���Ʒ�Ӧ������ʵ������Ϊ�տ�ʼ����������һ��ʱ��������ݲ�������Һ���ɺ�ɫ��Ϊ��ɫ��
[��չ����]
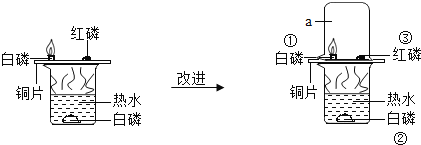
Ϊ�ⶨ��ʵ����Ʒ��̼���Ƶ�������������ͨ���ⶨ����ϡ���ᷴӦ�����ɶ�����̼�������������ڶ�����̼Ϊ���壬�����Ȳⶨ����Ӧ���������������ٽ���ܶȼ����������������������Ը�ʵ��װ����Ƶ�ԭ����ͨ���ⶨһ����������Ʒ��ϡ���ᷴӦ���ɵĶ�����̼����������̼���Ƶ�������������Ϊ������̼������ˮ������ˮ������Ӧ��������û���ڶ��ƿ�е�ˮ�ϲ�μ�ֲ���ͣ�������̼������ˮ�һ���ˮ��Ӧ��ʹ�òⶨ�Ľ��ƫС��

����Ŀ������ʵ������ܴﵽʵ��Ŀ���ǣ� ��
ѡ�� | ʵ��Ŀ�� | ʵ����� |
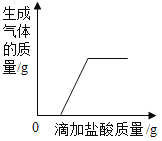
A | ����ľ̿�ۺ����� | ��ϡ���ᣬ�۲��������ݲ��� |
B | �������Ͷ�����̼ | ��ȼ�ŵ�ľ���ֱ�����ʢ����ļ���ƿ�� |
C | ��ȥһ����̼�е����� | �����建��ͨ�����ȵ�ͭ�� |
D | ��ȥFeSO4��Һ��������CuSO4 | ��������п�ۣ���ַ�Ӧ����� |
A.AB.BC.CD.D
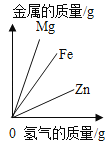
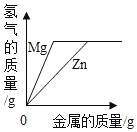
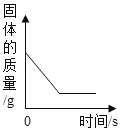
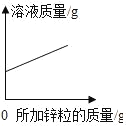
����Ŀ������ͼ������ȷ��ӳ��Ӧ�仯��ϵ���ǣ�������
|
|
|
|
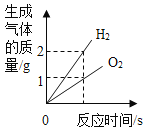
Mg��Zn��Fe��ϡ���ᷴӦ | ������������������������������þ�ۡ�п�� | ��ͭƬ����һ��������������Һ�� | ��һ���������Ȼ�п��������Һ�м���п�� |
A. A B. B C. C D. D