题目内容
【题目】如图表示某些物质间的转化关系.甲、乙是常见气体,丙是常见金属,C的水溶液呈蓝色,D是大理石的主要成分.(C:12 H:1 O:16)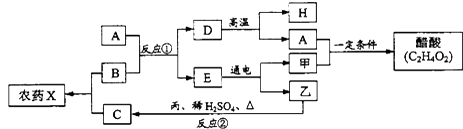
(1)化学式:甲 , H .
(2)反应①、②的化学方程式:
① ,
② .
(3)农业上常用B和C混合配制农药X,X的俗称为 .
【答案】
(1)H2,CaO
(2)CO2+Ca(OH)2=CaCO3↓+H2O,2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O
2CuSO4+2H2O
(3)波尔多液
【解析】C的水溶液呈蓝色,常见的含有铜离子的农药是波尔多液,故C是硫酸铜;常用硫酸铜与氢氧化钙配制波尔多液,故B是氢氧化钙;D是大理石的主要成分,那么D是碳酸钙;碳酸钙在高温时分解生成氧化钙和二氧化碳;E在通电的条件下反应,说明E是水。水通电生成氢气和氧气,甲和H能在一定条件下反应生成醋酸,根据质量守恒定律化学反应前后元素的种类不变,故A是二氧化碳,甲是氢气,那么H是氧化钙,乙是氧气。丙是常见金属,丙与氧气、硫酸反应生成硫酸铜,根据质量守恒定律化学反应前后元素的种类不变可知丙是金属铜。把推断出的物质代入转化关系中,推断正确。(1)甲是氢气,表示为H2;H是氧化钙,表示为CaO;(2)反应①是氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水:CO2+Ca(OH)2=CaCO3↓+H2O;反应②铜与氧气、硫酸在加热的条件下反应生成硫酸铜和水:2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O;(3)农业上常用氢氧化钙和硫酸铜混合配制农药波尔多液。
2CuSO4+2H2O;(3)农业上常用氢氧化钙和硫酸铜混合配制农药波尔多液。
【考点精析】关于本题考查的书写化学方程式、文字表达式、电离方程式,需要了解注意:a、配平 b、条件 c、箭号才能得出正确答案.

 科学实验活动册系列答案
科学实验活动册系列答案【题目】小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量/g | 10.8 | 9.6 | 8.1 | 8.1 |
试计算:
(1)完全反应后生成二氧化碳的质量为g;
(2)求该珍珠粉中碳酸钙的质量分数为。
【题目】溶液在生命活动和生产、生活中都起到十分重要的作用.
(1)将少量下列调味品加入水中,不能形成溶液的是__________________ .
a.食盐 b.蔗糖 c.味精 d.芝麻油
(2)碘酒中的溶剂为_________________________________ .
(3)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解得到溶液.加入KNO3固体的质量与所得溶液的质量如下表:
实验编号 | a | b | c | d |
加入KNO3固体的质量/g | 45 | 50 | 55 | 60 |
所得溶液的质量/g | 95 | 100 | 105 | 105 |
①实验a、b、c、d中,所得溶液一定饱和的是____________(填写实验编号).
②该温度下,KNO3的溶解度是___________g.
③取实验b所得溶液,若使其溶质质量分数变为20%,需加水___________g.
(4)在氯化亚铁和氯化铜的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体一定有______________ , 滤液中一定含有的溶质是_________________ .