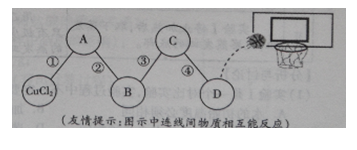
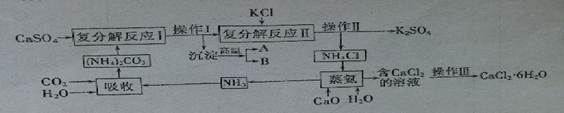
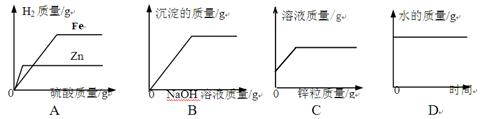
��Ŀ����
ij�о���ѧϰС������˲ⶨ������Ʒ����NaCl���ʣ���̼��������������ʵ�鷽������ش��������⣺
��1��̼������ӳ�������ʵ�鲽�裺
����������ƽ��ȡwg��Ʒ�����ձ��м�ˮ�ܽ⣻
�ڼ���������BaCl2��Һ�ɷַ�Ӧ��֤����Ӧ��ʣ��ķ�����_______________________________________��
�۹��ˡ�ϴ�ӡ���������������Ϊmg������Ʒ��̼���Ƶ���������Ϊ_______________________��
��2�����巨��ѧϰС��������ͼװ�òⶨ��Ʒ��̼���Ƶ�����������
��ʵ��װ������ʢ�ŵ��Լ�Ϊ______________��װ�ö���������______________________________________
______________________��
��ѧϰС��ͨ��������װ��ʵ��ǰ���������ȷ��������̼��������ʵ���еμ�ϡ������ٶȹ��죬�����������������ᵼ�²����Ʒ��̼���Ƶ���������______________����д��ƫ�ߡ�����ƫ�͡����䡱����
��3�����Ȼ��Ʒ��������������ʵ�鷽������ȡһ����������Ʒ�����ձ��м�ˮ�ܽ⣻____________________
________________________________________________________________________________________�����ˡ�ϴ�ӡ��������������������������Ȼ��Ƶ��������ٵ���Ʒ��̼���Ƶ�����������
��1��̼������ӳ�������ʵ�鲽�裺
����������ƽ��ȡwg��Ʒ�����ձ��м�ˮ�ܽ⣻
�ڼ���������BaCl2��Һ�ɷַ�Ӧ��֤����Ӧ��ʣ��ķ�����_______________________________________��
�۹��ˡ�ϴ�ӡ���������������Ϊmg������Ʒ��̼���Ƶ���������Ϊ_______________________��
��2�����巨��ѧϰС��������ͼװ�òⶨ��Ʒ��̼���Ƶ�����������
��ʵ��װ������ʢ�ŵ��Լ�Ϊ______________��װ�ö���������______________________________________
______________________��
��ѧϰС��ͨ��������װ��ʵ��ǰ���������ȷ��������̼��������ʵ���еμ�ϡ������ٶȹ��죬�����������������ᵼ�²����Ʒ��̼���Ƶ���������______________����д��ƫ�ߡ�����ƫ�͡����䡱����
��3�����Ȼ��Ʒ��������������ʵ�鷽������ȡһ����������Ʒ�����ձ��м�ˮ�ܽ⣻____________________
________________________________________________________________________________________�����ˡ�ϴ�ӡ��������������������������Ȼ��Ƶ��������ٵ���Ʒ��̼���Ƶ�����������
���������ã�ȡ�����ϲ���Һ�μӣΣ����ã�����Һ���а�ɫ�������ɣ�֤���£��l����ʣ�ࣨ���֣�����������ͬ�����֣��� ���������������֣�
���������������֣�
������Ũ���ᣨ���֣�������ֹ�����еĶ�����̼��ˮ����������У����֣���ƫ�ͣ����֣�
��������������ϡ���ᣨ���֣����ټ���������������Һ�����֣�
 ���������������֣�
���������������֣�������Ũ���ᣨ���֣�������ֹ�����еĶ�����̼��ˮ����������У����֣���ƫ�ͣ����֣�
��������������ϡ���ᣨ���֣����ټ���������������Һ�����֣�
֤����Ӧ��BaCl2�Ƿ���ʣ�����ͨ������̼������Һ�����Ƿ���������ķ������м��飻���ݻ�ѧ����ʽ���̼���Ƶ�������Ȼ�������Ʒ�������������̼���Ƶ������������������巨���вⶨʱ������ȷ�ⶨ������̼������������������ö�����̼�����л��е�ˮ��������װ�ñ��У���������Ӧ��ʢ��Ũ���װ�ö��������Ƿ�ֹ�����еĶ�����̼��ˮ����������У�ʵ���еμ�ϡ������ٶȹ��죬�����������������ᵼ�¶�����̼���ղ���ȫ������ʱ������̼������ƫС����Ʒ��̼���Ƶ�����������ƫ�ͣ����Ȼ��Ʒ���ԭ����ͨ���Ȼ��Ʋ����ij���������Ȼ��Ƶ�������Ȼ�����̼���Ƶ�����������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ