题目内容
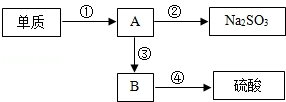
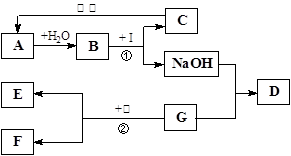
A~I为初中化学中常见物质。已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、I均为只含有一种溶质的溶液,甲为锌粉和铁粉的混合物。“→”表示物质间存在着相应的转化关系(部分生成物末标出),它们之间的关系如下图所示。请回答下列问题:
(1)A的化学式是 。
(2)写出B与I反应的化学方程式: 。
(3)将溶液G与甲充分反应后过滤,得到滤渣E和滤液F,向滤渣E中加入稀盐酸,无明显现象,则滤液F中一定含有的阳离子是 。

(1)A的化学式是 。
(2)写出B与I反应的化学方程式: 。
(3)将溶液G与甲充分反应后过滤,得到滤渣E和滤液F,向滤渣E中加入稀盐酸,无明显现象,则滤液F中一定含有的阳离子是 。
(1)CaO (2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (3)Zn2+、Fe2+
试题分析:根据题意分析,C为大理石的主要成分,所以C为碳酸钙;再根据图示,B能与I反应,生成C碳酸钙沉淀和氢氧化钠,结合复分解反应相互交换成分的特征可知,B、I分别是碳酸钠和氢氧化钙;又A为金属氧化物,且A能与水反应生成B,可知B是碱溶液,即为氢氧化钙,所以A是氧化钙,I是碳酸钠;再根据图示,氢氧化钠能与G溶液反应,生成D蓝色沉淀,同样结合复分解反应相互交换成分的特征可知,D为氢氧化铜沉淀。
(1)根据上面的分析可知,A为氧化钙,故化学式为CaO。
(2)B与I的反应即为氢氧化钙和碳酸钠的反应,能生成碳酸钙沉淀和氢氧化钠,故反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(3)根据上面的分析,由于G和氢氧化钠反应生成氢氧化铜沉淀,可知G为铜盐;又因为甲为锌粉和铁粉的混合物,故其加入铜盐中后会发生三个反应,即锌与铜盐反应生成铜和锌盐,铁和铜盐反应生成亚铁盐和铜,锌与反应生成的亚铁盐反应生成铁和锌盐;由于向滤渣E中加入稀盐酸,无明显现象,则说明没有氢前金属的剩余,所以溶液中一定含有Zn2+、Fe2+;由于无法确定铜是否被完全置换出来,故无法确定溶液中是否含有铜离子。
点评:在解此类题时,先要找准“题眼”,即有特征的物质或反应现象等,然后再根据题中的条件进行推导即可;此外,熟练掌握复分解反应的特征,以及常见酸碱盐的特性,是解答本题的关键。

练习册系列答案
相关题目