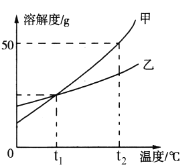
题目内容
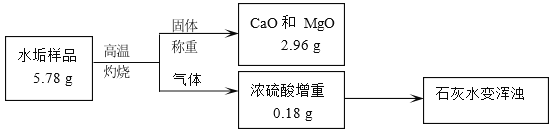
【题目】水垢中一般含 CaCO3、Mg(OH)2,可能含有 MgCO3(不考虑其他任何杂质)。某同学取不含结晶水的水垢样品进行研究(过程如图),下列说法正确的是
A. 该水垢灼烧生成 CO2 气体 2.64 g
B. 该水垢中一定含有 CaCO3、Mg(OH)2 ,一定不含 MgCO3
C. 该水垢中一定含有 CaCO3、Mg(OH)2,可能含有 MgCO3
D. 该水垢中一定含有 CaCO3、Mg(OH)2 和 MgCO3
【答案】AD
【解析】
由质量守恒定律可知,该水垢灼烧生成CO2气体的质量=5.78g-2.96g-0.18g=2.64g;假设该水垢中不含碳酸镁,则:碳酸钙在高温的条件下分解为氧化钙和二氧化碳,氢氧化镁在高温的条件下分解为氧化镁和水。根据水的质量计算出生成氧化镁的质量,再进一步计算出氧化钙的质量,根据氧化钙的质量,利用化学方程式计算出碳酸钙的质量;根据二氧化碳的质量利用化学方程式计算出碳酸钙的质量,比较计算结果是否相等,若相同,则不含碳酸镁,若不相等,则一定含有碳酸镁。
浓硫酸增重的质量即为氢氧化镁分解生成水的质量,设生成0.18g水的同时生成氧化镁的质量为x,则:
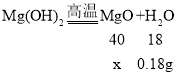
![]() x=0.4g;则氧化钙的质量为:2.96g-0.4g=2.56g;
x=0.4g;则氧化钙的质量为:2.96g-0.4g=2.56g;
设:生成2.56g氧化钙需要碳酸钙的质量为y。

![]() y=4.57g;
y=4.57g;
设:生成2.64g二氧化碳需要碳酸钙的质量为z;
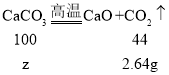
![]() z=5.82g;因为4.57g≠5.82g,所以该水垢中一定含有CaCO3、Mg(OH)2和MgCO3。故选AD。
z=5.82g;因为4.57g≠5.82g,所以该水垢中一定含有CaCO3、Mg(OH)2和MgCO3。故选AD。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案
相关题目