题目内容
用含有
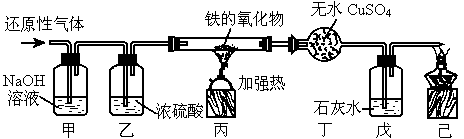
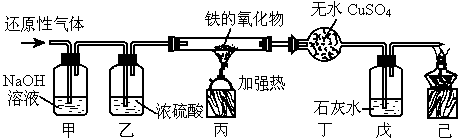
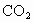 和水蒸气杂质的某种还原性气体测定一种铁的氧化物的组成.实验装置如图所示,请回答:
和水蒸气杂质的某种还原性气体测定一种铁的氧化物的组成.实验装置如图所示,请回答:
(1)
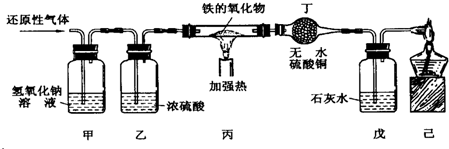
甲装置的作用是________,甲中发生化学反应的化学方程式为______________.(2)
如果将甲装置和乙装置的顺序对调,对实验有无影响?____________.(3)
实验过程中丁装置没有明显变化,而戊装置中溶液出现了白色沉淀,则该还原性气体是________.(4)
当丙装置中铁的氧化物全部被还原后,称量剩余固体质量为16.8g,同时测得戊装置的质量增加了17.6g,则该铁的氧化物中铁元素与氧元素的质量比为_________,该铁的氧化物的化学式为_________.(5)
上述实验装置中如果没有甲装置,将使测得结果中铁元素与氧元素的质量比________(填“偏小”或“无影响”);如果没有己装置,可能产生的后果是________.
答案:略
解析:
解析:
|
(1)除去混合气体中的二氧化碳; 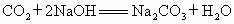 (2)有影响,将无法除去水蒸气(3)一氧化碳(4)21∶8; (2)有影响,将无法除去水蒸气(3)一氧化碳(4)21∶8;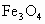 (5)偏小;对空气造成污染 (5)偏小;对空气造成污染
根据题意,要测定铁的氧化物的组成,是用还原性气体将这种铁的氧化物还原后,通过测定生成铁的质量和另一种氧化产物的质量,最终求出其中的铁元素和氧元素的质量比.我们在九年级接触到的还原性气体只有 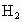 和CO两种,它们还原铁的氧化物后生成的产物分别是水和二氧化碳,因此,为确定是哪种还原性气体,必须先将原气体中混有的 和CO两种,它们还原铁的氧化物后生成的产物分别是水和二氧化碳,因此,为确定是哪种还原性气体,必须先将原气体中混有的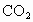 和 和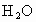 杂质在通入丙装置之前除去.甲装置的用途是除去 杂质在通入丙装置之前除去.甲装置的用途是除去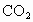 ,乙装置是用来除去水蒸气的.这两个装置不能颠倒,若先除去水蒸气,再通过氢氧化钠溶液除去 ,乙装置是用来除去水蒸气的.这两个装置不能颠倒,若先除去水蒸气,再通过氢氧化钠溶液除去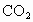 ,则出来的气体中又含有水蒸气.丁装置无明显变化,而戊装置出现了白色沉淀,说明该还原性气体被氧化后的生成物中没有水而含有二氧化碳.从而可判断出这种还原性气体中不含氢气而只含有一氧化碳气体. ,则出来的气体中又含有水蒸气.丁装置无明显变化,而戊装置出现了白色沉淀,说明该还原性气体被氧化后的生成物中没有水而含有二氧化碳.从而可判断出这种还原性气体中不含氢气而只含有一氧化碳气体.
设这种铁的氧化物的化学式为 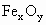
其中铁元素的质量为 16.8g,氧元素的质量为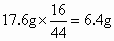 . .
铁元素与氧元素的质量比为 16.8g∶6.4g=21∶8,则 ;得 ;得 .即这种铁的氧化物的化学式为 .即这种铁的氧化物的化学式为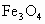 . .
本题属于综合性实验题,涉及常见单质及其化合物的重要性质,基本化学实验仪器、操作步骤及注意事项等内容.解答综合性实验题的基本思路是:①审清题意,明确实验要求;②根据实验要求,明确实验原理;③结合实验原理选择需要的仪器与药品;④明确实验操作步骤及注意事项;⑤根据实验现象,分析实验结果,得出正确结论. |

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目

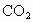 和水蒸气杂质的某种还原性气体测定一种铁的氧化物的组成.实验装置如图所示,请回答:
和水蒸气杂质的某种还原性气体测定一种铁的氧化物的组成.实验装置如图所示,请回答: