题目内容
请回答下列有关硫酸知识的问题:
(1)实验室用浓硫酸(溶质质量分数为98%,密度为1.84g/cm3)配制300g溶质质量分数11%的稀硫酸.(结果保留一位小数)
a计算:需浓硫酸______ml,水______ml.
b量取:用规格为50ml的量筒量取浓硫酸.
c稀释:稀释浓硫酸时,一定要把浓硫酸慢慢注入水中并不断搅拌.
(2)Fe、Cu、HCl、Ca(OH)2、Fe2O3、CO2、纯碱中不能与H2SO4发生化学反应的有______(填化学式),写出其中一个发生复分解反应的化学方程式______.
(3)某装浓硫酸的运输车因驾驶不慎,造成浓硫酸大面积泄漏事故.为使事故对环境造成的影响尽可能降低,下列措施中最佳措施为______.
A.用大量水冲洗 B.撒熟石灰 C.撒沙土 D.撒烧碱.
解:(1)设需要98%的硫酸的质量为x,
根据稀释前后溶质的质量不变可得:300g×11%=x×98%
解得:x≈33.7g;
需要水的质量为:稀释后溶液质量-浓硫酸的质量=300g-33.67g=266.3g;
根据V=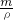 可得:
可得:
需要浓硫酸的体积为: ≈18.3mL,
≈18.3mL,
需要水的体积为: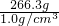 =266.3mL.
=266.3mL.
故填:18.3;266.3;
(2)在Fe、Cu、HCl、Ca(OH)2、Fe2O3、CO2、纯碱中,铁能和稀硫酸发生置换反应生成氢气,铜和稀硫酸不反应;HCl属于酸,不和稀硫酸反应;氢氧化钙是碱,能和稀硫酸发生中和反应,氧化铁能和稀硫酸发生复分解反应生成硫酸铁和水;CO2是酸性气体,不能与硫酸反应;纯碱是碳酸盐,能和稀硫酸反应生成二氧化碳,故不能与
H2SO4发生化学反应的有Cu、HCl和CO2.
故填:Cu、HCl和CO2.3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(3)浓硫酸大面积泄漏用水冲洗和用沙土覆盖都不能清除浓硫酸对土壤的污染,烧碱具有强腐蚀性,会造成二次污染,故选用呈弱碱性的熟石灰来清理浓硫酸.
故答案为:B.
分析:(1)溶液稀释前后的溶质质量不变,据此可以求得所需的浓硫酸的质量,溶液的质量=浓硫酸的质量+水的质量;然后由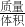 =密度可以求得所需的浓硫酸、水的体积;
=密度可以求得所需的浓硫酸、水的体积;
(2)根据物质间的反应规律判断.
(3)根据各措施选用的物质的性质及造成的后果判断.
点评:本题主要考查了溶液的配制、物质的性质和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.
根据稀释前后溶质的质量不变可得:300g×11%=x×98%
解得:x≈33.7g;
需要水的质量为:稀释后溶液质量-浓硫酸的质量=300g-33.67g=266.3g;
根据V=
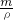 可得:
可得:需要浓硫酸的体积为:
 ≈18.3mL,
≈18.3mL,需要水的体积为:
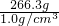 =266.3mL.
=266.3mL.故填:18.3;266.3;
(2)在Fe、Cu、HCl、Ca(OH)2、Fe2O3、CO2、纯碱中,铁能和稀硫酸发生置换反应生成氢气,铜和稀硫酸不反应;HCl属于酸,不和稀硫酸反应;氢氧化钙是碱,能和稀硫酸发生中和反应,氧化铁能和稀硫酸发生复分解反应生成硫酸铁和水;CO2是酸性气体,不能与硫酸反应;纯碱是碳酸盐,能和稀硫酸反应生成二氧化碳,故不能与
H2SO4发生化学反应的有Cu、HCl和CO2.
故填:Cu、HCl和CO2.3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(3)浓硫酸大面积泄漏用水冲洗和用沙土覆盖都不能清除浓硫酸对土壤的污染,烧碱具有强腐蚀性,会造成二次污染,故选用呈弱碱性的熟石灰来清理浓硫酸.
故答案为:B.
分析:(1)溶液稀释前后的溶质质量不变,据此可以求得所需的浓硫酸的质量,溶液的质量=浓硫酸的质量+水的质量;然后由
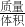 =密度可以求得所需的浓硫酸、水的体积;
=密度可以求得所需的浓硫酸、水的体积;(2)根据物质间的反应规律判断.
(3)根据各措施选用的物质的性质及造成的后果判断.
点评:本题主要考查了溶液的配制、物质的性质和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
相关题目