题目内容
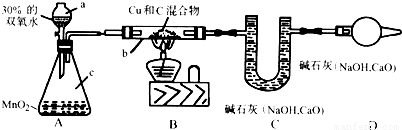
某课外小组同学对均匀含碳的铜粉样品进行铜的质量分数测定,采用如图所示进行实验(气密性良好,图中铁架台等仪器已略去),他们利用30%的双氧水和二氧化锰作用,制得实验中所需氧气(2H2O2
2H2O+O2↑)

请回答下列有关问题:
(1)仪器a的名称
(2)A装置还可用于制备
(3)装置D的作用是
(4)已知硬玻璃管b内装有铜和碳的混合物4g,当完全反应,停止加热,冷却后,称得装置质量增加2.2g,则样品铜的质量分数是
(5)实验完成后,教师评议说,按上述实验设计,即使b中完全反应,c中完全吸收,也不会得出准确的结果,经讨论有同学提出A、B之间加一装置,再次实验后,得到较准确的结果,请你判断,原来实验装置测得铜的质量分数偏
| ||

请回答下列有关问题:
(1)仪器a的名称
分液漏斗
分液漏斗
,c的名称锥形瓶
锥形瓶
.(2)A装置还可用于制备
二氧化碳
二氧化碳
(气体).(3)装置D的作用是
吸收空气中二氧化碳和水,防止进入C装置影响实验结果
吸收空气中二氧化碳和水,防止进入C装置影响实验结果
.(4)已知硬玻璃管b内装有铜和碳的混合物4g,当完全反应,停止加热,冷却后,称得装置质量增加2.2g,则样品铜的质量分数是
85%
85%
.(5)实验完成后,教师评议说,按上述实验设计,即使b中完全反应,c中完全吸收,也不会得出准确的结果,经讨论有同学提出A、B之间加一装置,再次实验后,得到较准确的结果,请你判断,原来实验装置测得铜的质量分数偏
偏小
偏小
(填“大”或“小”),在A和B之间加入的实验装置可以是洗气瓶
洗气瓶
,其中盛放的药品是浓硫酸
浓硫酸
.分析:(1)根据常见的化学仪器进行分析解答.
(2)A装置属于“固液常温型”制取气体,据此进行分析解答.
(3)D中碱石灰是为了防止空气中的二氧化碳和水进入C中被碱石灰水吸收,影响实验结果.
(4)反应生成的二氧化碳的质量为装置C增重的质量,根据二氧化碳的质量计算出碳元素的质量,进而可计算出铜的质量及样品铜的质量分数.
(5)根据装置A中氧气逸出时要带出水蒸气,结合装置图进行分析解答.
(2)A装置属于“固液常温型”制取气体,据此进行分析解答.
(3)D中碱石灰是为了防止空气中的二氧化碳和水进入C中被碱石灰水吸收,影响实验结果.
(4)反应生成的二氧化碳的质量为装置C增重的质量,根据二氧化碳的质量计算出碳元素的质量,进而可计算出铜的质量及样品铜的质量分数.
(5)根据装置A中氧气逸出时要带出水蒸气,结合装置图进行分析解答.
解答:解:(1)仪器a是分液漏斗,c是锥形瓶.
(2)A装置属于“固液常温型”制取气体,在还可用于制备二氧化碳、氢气等气体.
(3)为防止外界空气进入C装置被碱石灰吸收,影响实验结果,故D装置的作用是吸收空气中的二氧化碳和水蒸气,防止进入C装置影响实验结果.
(4)根据质量守恒定律,反应生成的二氧化碳的质量为装置C增重的质量,同理混合物中碳的质量即为二氧化碳中碳的质量,即 2.2g×
×100%=0.6g,所以铜的质量为4g-0.6g=3.4g,则铜的质量分数为:
×100%=85%.
(5)因为装置A中氧气逸出时要带出水蒸气,水蒸气通过B装置后可以被装置C的碱石灰吸收,使C装置增重的质量偏大,从而碳的质量增大,铜的质量偏小,铜的质量分数偏小.所以应在A和B之间加一个洗气瓶,以除去氧气中的水蒸气,可选用浓硫酸作干燥剂.
故答案为:(1)分液漏斗;锥形瓶;(2)二氧化碳等;(3)吸收空气中二氧化碳和水,防止进入C装置影响实验结果;(4)85%;(5)偏小;洗气瓶;浓硫酸.
(2)A装置属于“固液常温型”制取气体,在还可用于制备二氧化碳、氢气等气体.
(3)为防止外界空气进入C装置被碱石灰吸收,影响实验结果,故D装置的作用是吸收空气中的二氧化碳和水蒸气,防止进入C装置影响实验结果.
(4)根据质量守恒定律,反应生成的二氧化碳的质量为装置C增重的质量,同理混合物中碳的质量即为二氧化碳中碳的质量,即 2.2g×
| 12 |
| 44 |
| 3.4g |
| 4g |
(5)因为装置A中氧气逸出时要带出水蒸气,水蒸气通过B装置后可以被装置C的碱石灰吸收,使C装置增重的质量偏大,从而碳的质量增大,铜的质量偏小,铜的质量分数偏小.所以应在A和B之间加一个洗气瓶,以除去氧气中的水蒸气,可选用浓硫酸作干燥剂.
故答案为:(1)分液漏斗;锥形瓶;(2)二氧化碳等;(3)吸收空气中二氧化碳和水,防止进入C装置影响实验结果;(4)85%;(5)偏小;洗气瓶;浓硫酸.
点评:本题难度较大,属于综合性实验题,理清实验思路,根据实验目的分析组合装置中各个装置的作用是解答本题的关健.

练习册系列答案
相关题目
 2H2O+O2↑)
2H2O+O2↑)
 2H2O+O2↑)请回答下列有关问题:
2H2O+O2↑)请回答下列有关问题: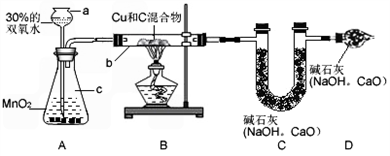
 2H2O+O2↑)
2H2O+O2↑)