题目内容
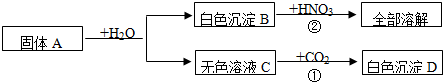
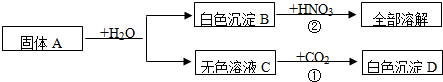
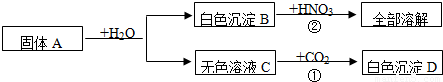
有一包固体A,可能含有Cu(OH)2、CuO、Cu、NaOH、Na2CO3、CaCl2中的几种,取少量的A做如下实验,现象如图所示.

根据实验过程中的现象判断:
(1)气体D是 (填化学式,下同),沉淀G是 。
(2)混合物A中的可能组成有 、 、 。
(3)溶液F中,一定存在溶质是 。
(4)写出过程③中可能发生的化学反应中的一个化学方程式 。
(5)滤液B中,可能存在的溶质是 ,若要证明该物质是否存在,应补做实验是(写出主要实验步骤、现象及结论) 。
(1)CO2; Cu (2)Cu、Na2CO3、CuO (3) CuSO4、H2SO4
(4)CuO+H2SO4═CuSO4+H2O或Cu(OH)2+H2SO4═CuSO4+2H2O
(5)NaOH;取溶液B少许滴加过量的BaCl2溶液静置(或过滤),取上层清液滴入酚酞,若变红色则含有NaOH,反之则无NaOH
【解析】
试题分析:抓住该题中重要的反应及反应现象,根据滤液B和稀盐酸反应生成气体D,再就是原固体中只有碳酸钠能够和酸反应生成气体,由此推断原固体中一定含有碳酸钠,而碳酸钠能和氯化钙反应生成碳酸钙沉淀,两物质不能共存。由于沉淀C和稀硫酸反应并没有气泡冒出,说明原固体中一定没有氯化钙;往沉淀C中加入过量的稀硫酸,得到蓝色溶液和沉淀G,说明一定有氧化铜和氢氧化铜的一种或两种,在原固体涉及的物质中只有铜难溶于稀硫酸,因此一定有铜。
(1)由于原固体中只有碳酸钠能和稀盐酸反应生成二氧化碳气体,也只有铜不溶于水,也不溶于稀硫酸,故选CO2,Cu。
(2)由于原固体中一定含有碳酸钠和铜,而碳酸钠能和氯化钙反应生成碳酸钙沉淀,两物质不能共存,而且沉淀C和稀硫酸反应并没有气泡冒出,说明原固体中一定没有氯化钙,往沉淀C中加入过量的稀硫酸,得到蓝色溶液和沉淀G,说明一定有氧化铜和氢氧化铜的一种或两种,但是无法确定氢氧化钠的存在,故混合物A的可能组成是Cu、Na2CO3、CuO;Cu、Na2CO3、CuO;Cu、Na2CO3、CuO、Cu(OH)2;Cu、CuO、Cu(OH)2、Na2CO3、NaOH(答对一个即可)。
(3)蓝色溶液中一定含有生成的硫酸铜,由于稀硫酸是过量的,因此蓝色溶液中还有硫酸,故选CuSO4、H2SO4。
(4)CuO+H2SO4═CuSO4+H2O或Cu(OH)2+H2SO4═CuSO4+2H2O。
(5)由于氢氧化铜、氧化铜、铜都不能溶于水,也不和其他物质发生反应,因此滤液B中可能还有氢氧化钠。氢氧化钠溶液显碱性,因此检验方法是取溶液B少许滴加过量的BaCl2溶液静置(或过滤),取上层清液滴入酚酞,若变红色则含有NaOH,反之则无NaOH。
考点:考查实验探究物质的组成成分以及含量;物质的性质以及物质的检验