题目内容
【题目】(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝。金属大规模被使用的先后顺序跟____________(选填字母)(A.地壳中金属元素的含量;B.金属的导电性;C.金属的活动性)关系最大。
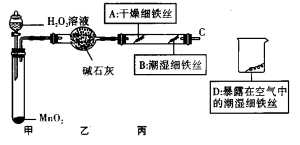
(2)铁制品锈蚀的过程,实际上是铁与空气中的____________和____________等发生化学反应的过程。据有关资料报导,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%。保护金属资源,人人有责。请写出一条防止铁制品生锈的方法________________________________________________。目前世界上已有50%以上的废钢铁得到回收利用,其目的是____________(选填字母)。
A.节约金属资源;B.减少矿物开采,合理利用资源;C.防止钢铁生锈
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为________________________________________________。
(4)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合如图实验方案回答下列问题:

步骤①中,金属X是____________;
步骤②中,加入过量稀硫酸的目的是__________,该反应的化学方程式为__________________________。
【答案】(1)C(2)水、氧气,涂油漆,AB(3)Fe+CuSO4==FeSO4+Cu
(4)Fe,将多余的铁除去,Fe+H2SO4==FeSO4+H2↑
【解析】
试题分析:(1)根据金属活动性顺序Al、Fe、Cu,故金属大规模被使用的先后顺序跟金属的活动性有关,金属活动性越弱的,越早被利用;
(2)铁生锈的条件是铁与氧气、水同时接触;防止铁生锈的原理是破坏铁生锈的条件,方法有在铁制品的表面涂油漆等;回收废旧金属的目的是节约金属资源和减少矿物开采,合理利用资源;
(3)根据金属活动性顺序的应用:位于前面的金属能把后面的金属从化合物的溶液中置换出来,故铁能将硫酸铜中的铜置换出来生成硫酸亚铁和铜:Fe+CuSO4==FeSO4+Cu;
(4)要从含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,那么要把硫酸铜溶液中的铜置换出来,故加入的金属是铁,铁和硫酸铜溶液反应生成铜和硫酸亚铁;由于加入的铁的过量的,故要把铁除去,故加入过量的稀硫酸,稀硫酸与铁反应生成硫酸亚铁和氢气;最后通过过滤能得到铜,通过蒸发能得到硫酸亚铁晶体。