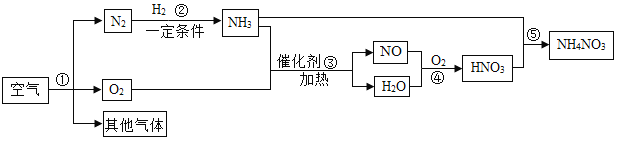
��Ŀ����
����Ŀ�����������ڹ���������������Ҫ�����ã�ͼ1Ϊ�ߩ�15�ɻ�������������ɣ�
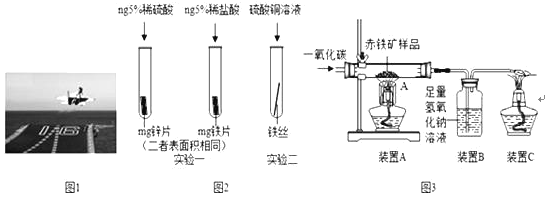
��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ��� �� ��
��2����װǰ�������������⼣�߰ߣ���������ʴ��Ҫ����������е� ��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽ ��
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ������С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺
��ʵ��һ�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ���������������� ��
��ʵ����У������� ����֤�����Ļ��ǿ��ͭ��
��4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ�������ⶨ��������������������������װ�����������ã���Ӧ��ȫ�ҳ������е����ʲ��μӷ�Ӧ�����س�������Ʒ������Ϊwg����
��װ��A���������Ļ�ѧ����ʽΪ ��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ������������ ��
���𰸡���1�����ᡢǿ�ȴ�2��ˮ������ Fe2O3+6HCl=2FeCl3+3H2O
��3�������õ��ͬ��û�п��Ʊ��� ���к�ɫ��������
��4����Fe2O3+3CO ![]() 2Fe+ 3CO2 CO2+2NaOH=Na2CO3+H2O
2Fe+ 3CO2 CO2+2NaOH=Na2CO3+H2O
Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ֪����Ӧ���������Ʒ��������
��������
�����������1�����Ͻ���ʵ���Ҫ�ŵ������ᡢǿ�Ⱥ�Ӳ�Ⱥá���2��������ʴ����������ˮ������ͬʱ�Ӵ���ϡ�����������ⷴӦ����ѧ����ʽΪ��Fe2O3+6HCl=2FeCl3+3H2O
��3���� ���Ա����飬Ҫ����ʵ����������ֻ��һ��������ͬʱ������֪����������ʵ���Ƿ���Ӱ�졣��ʵ�������õ���Ӧ����ͬ���� Fe+CuSO4=FeSO4+Cu ���ɵĺ�ɫ��ͭ���������ı��档
��4���� װ��A����������ԭ������ѧ����ʽΪ��Fe2O3+3CO![]() 2Fe+ 3CO2 �� Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ֪����Ӧ���������Ʒ��������Ȼ����ݷ�Ӧǰ�����IJ����������������Ʒ��������������������
2Fe+ 3CO2 �� Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ֪����Ӧ���������Ʒ��������Ȼ����ݷ�Ӧǰ�����IJ����������������Ʒ��������������������