题目内容
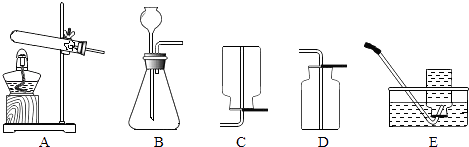
【题目】如图为气体发生装置和气体收集装置示意图: 
(1)写出标号仪器名称.①;② .
(2)实验室用过氧化氢溶液分别制取氧气.
①气体发生装置应选 , 反应容器中要加入MnO2 , 作用是作 .
②盛满氧气的集气瓶应(填“正”或“倒”)放在桌上.细铁丝在氧气中燃烧时,可观察到的现象是 .
(3)已知氨气密度比空气小,氮气溶于水可制得氨水,实验室常用加热熟石灰和硫酸铵的固体混合物来制取氨气,则制氨气的气体发生装置应选 , 收集装置应选 .
(4)确定一瓶无色气体是氧气而不是氨气的实验方法是 .
(5)用高锰酸钾制取氧气时,装置A还需要做的一点改动是 .
(6)高温加热l0g碳酸钙,一段时问后停止加热,测得剩余固体中钙元素的质量分数为50%.
①若l0g碳酸钙全部分解可产生多少克氧化钙?
②实际反应生成的二氧碳是多少克?
【答案】
(1)为铁架台;为集气瓶
(2)B;催化剂;正;剧烈燃烧,火星四射,生成黑色固体,放出热量
(3)A;E
(4)把带火星的木条插入瓶中,复燃即为氧气
(5)试管口放一团棉花
(6)解:①设生成氧化钙的质量为x
CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
100 56
10g x
![]() x=5.6g
x=5.6g
②原碳酸钙10g中的钙元素质量为10g× ![]() ×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=4g÷50%=8g
×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=4g÷50%=8g
根据质量守恒定律,反应生成二氧化碳的质量=10g﹣8g=2g
答:①若10g碳酸钙全部分解可产生氧化钙5.6g;
②实际反应生成的二氧化碳2g.
故答案为:①5.6g;②2g.
【解析】解:(1)熟记常用仪器的名称可知①为铁架台;②为集气瓶.(2)①反应物的状态是固态和液态,反应条件是常温,应选固﹣液不加热型的发生装置;二氧化锰是过氧化氢溶液制氧气的催化剂,起催化作用.所以答案是:B; 催化剂
②氧气的密度比空气大,集气瓶应正放;细铁丝在氧气中燃烧的现象是剧烈燃烧,火星四射,生成黑色固体,放出热量.所以答案是:正; 剧烈燃烧,火星四射,生成黑色固体,放出热量.(3)反应物的状态是固态,反应条件是加热,应选固﹣固加热型的发生装置;氨气极易溶于水,不能用排水法收集,氨气的密度比空气小,可用向下排空气法收集.所以答案是:A; E(4)氧气能使带火星的木条复燃,可以把带火星的木条插入瓶中,复燃即为氧气.所以答案是:把带火星的木条插入瓶中,复燃即为氧气;(5)实验室用高锰酸钾制取氧气时,需要在试管口放一团棉花,防止高锰酸钾粉末进入导管,所以装置A还需要做的一点改动是:试管口放一团棉花.所以答案是:试管口放一团棉花;
【考点精析】解答此题的关键在于理解氧气的制取装置的相关知识,掌握发生装置:固固加热型、固液不加热型,以及对氧气的收集方法的理解,了解收集装置:根据物质的密度、溶解性;排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气;)用排空气法收集气体时,导管伸到集气瓶底部.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案