题目内容
【题目】在工业制得的烧碱中常常会混有三种杂质:氯化钠、硫酸钠、碳酸钠.现有一份工业烧碱样品,为了研究它的组成,某小组同学将其配成溶液后,做如下探究,请你也参与其中. 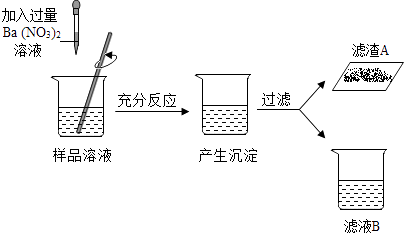
(1)【探究实验1】
根据实验现象,写出一个产生沉淀的化学方程式
【提出猜想】同学们根据上面实验猜测该烧碱样品中可能含有的杂质为:
小冰:碳酸钠
小城:硫酸钠
小美:碳酸钠和硫酸钠
(2)【探究实验2】
为了弄清组成,同学们进一步探究.小冰对滤渣A展开探究,向滤渣A中滴加足量的稀盐酸,观察的现象,证明自己的猜想正确.
(3)【评价与交流】小城提出若将盐酸替换成稀硫酸也可以对上述猜想做出正确判断,请你评价小城的观点;
(4)【探究实验3】小美对滤液B展开探究,取样,向其中滴加酚酞试液,实验看到的现象是;她又向其中滴加 , 观察到了预测的现象,证明溶液中含有氯化钠.
(5)【归纳与总结】回顾整个探究过程.大家认为在探究溶液中溶质的组成时,我们选择试剂要注意(答一条即可)
【答案】
(1)Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3 , 或Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3
(2)沉淀全部溶解
(3)不正确,稀硫酸能和碳酸钡反应生成硫酸钡、水和二氧化碳
(4)酚酞试液变红色;硝酸银溶液
(5)不能相互干扰
【解析】解:【探究实验1】
根据实验现象可知,产生的沉淀可能是硫酸钡,也可能是碳酸钡,也可能是硫酸钡和碳酸钡,硝酸钡和硫酸钠、碳酸钠反应的化学方程式为:Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3 , Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3 .
故填:Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3 , 或Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3 .
【探究实验2】
小冰对滤渣A展开探究,向滤渣A中滴加足量的稀盐酸,观察到沉淀全部溶解,说明沉淀都是碳酸钡,进一步说明杂质中含有碳酸钠,不含有硫酸钠,证明自己的猜想正确.
故填:沉淀全部溶解.
【评价与交流】
若将盐酸替换成稀硫酸,稀硫酸能和碳酸钡反应生成硫酸钡、水和二氧化碳,导致碳酸钡沉淀转化成硫酸钡沉淀,不能得出正确的结论.
故填:不正确,稀硫酸能和碳酸钡反应生成硫酸钡、水和二氧化碳.
【探究实验3】
小美对滤液B展开探究,取样,向其中滴加酚酞试液,实验看到的现象是酚酞试液变红色;
她又向其中滴加硝酸银溶液,观察到了预测的现象,证明溶液中含有氯化钠.
故填:酚酞试液变红色;硝酸银溶液.
【归纳与总结】
回顾整个探究过程.大家认为在探究溶液中溶质的组成时,我们选择试剂要注意不能相互干扰.
故填:不能相互干扰.
答案:(1)Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3 , 或Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3 . (2)沉淀全部溶解.(3)不正确,稀硫酸能和碳酸钡反应生成硫酸钡、水和二氧化碳.(4)酚酞试液变红色;(5)硝酸银溶液.(6)不能相互干扰.
【考点精析】利用书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案