题目内容
【题目】(5分)某化学兴趣小组的同学利用如图所示的装置验证Na2CO3样品的纯度(样品中的杂质与稀盐酸不反应),小资料:无水CaCl2可作干燥剂,与CO2不反应。

(1)有关反应的化学方程式为______。
(2)装置中的“无水CaCl2”的作用是______。
(3)若反应前,称量整个装置及药品的总质量为598.6g,其中样品质量为6g; 打开分液漏斗向广口瓶中加入足量的稀盐酸,充分反应后,应该进行的操作是______,然后再第二次称量整个装置及药品的总质量为596.4g,则该样品的纯度为(样品中碳酸钠的质量分数)为_________。
【答案】(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)吸收水蒸气
(3)打开止水夹用打气筒自a向装置中鼓入空气(2分) 88.3%
【解析】
试题分析:(1)碳酸钠与稀盐酸反应,生成氯化钠二氧化碳和水;
(2)无水氯化钙可作干燥剂,能吸收二氧化碳中的水蒸气;
(3)打开止水夹用打气筒自a向装置中鼓入空气,将产生二氧化碳气体排出,发现前后质量减少了598.6g-596.4g=2.2g,即为二氧化碳质量,在利用化学方程式计算出碳酸钠质量。
解:设碳酸钠质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 2.2g
106/44=X/2.2g X=5.3g
则碳酸钠纯度为5.3g/6g×100%=88.3%

【题目】(6分)化学是在原子、分子水平上研究物质及其变化的科学。
(1)现有下列化学式或粒子符号:①2CO ②Ca2+ ③2H ④O2。其中,“2”表示两个分子的是 (填序号,下同),表示每个粒子带两个单位电荷的是_______;
(2)一定条件下,甲和乙反应生成丙和丁(四种物质均由分子构成),反应前后微观示意图如图所示。下列说法正确的是 (填字母编号)。
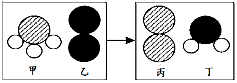
A.反应前后共有4种原子
B.该反应有单质生成
C.反应前后元素化合价都不变
D.化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2:3
(3)胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成粒子:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
构成粒子 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的粒子也有差异。
①Mg(OH)2起抗酸作用的粒子是 (填粒子符号,下同);
②铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3 + 5HCl == MgCl2 + AlCl3 + 4H2O + CO2↑。
铝碳酸镁起抗酸作用的两种粒子是 、 。