题目内容
【题目】某纯碱样品中含有少量NaCl,小丽同学取该样品23g全部溶解于150g水中,再逐滴加人160g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示.计算当恰好完全反应时: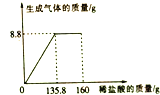
(1)产生的二氧化碳的质量是克;
(2)样品中碳酸钠的质量为克;
(3)此时所得到的溶液中氯化钠的质量分数为多少?(写出必要的计算过程,结果保留到0.1% ).
【答案】
(1)8.8
(2)21.2
(3)
设碳酸钠的质量为x,生成的氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
![]()
x=21.2g y=23.4g
样品中氯化钠的质量为:23g﹣21.2g=1.8g
故反应后氯化钠溶液的溶质质量分数为: ![]() ×100%=8.4%
×100%=8.4%
答:所得到的溶液中溶质的质量分数为8.4%。
【解析】解:(1)据图可以看出,生成的二氧化碳的质量为8.8g,故填:8.8;
2)设碳酸钠的质量为x,生成的氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 8.8g![]()
x=21.2g y=23.4g
样品中氯化钠的质量为:23g﹣21.2g=1.8g
故反应后氯化钠溶液的溶质质量分数为: ![]() ×100%=8.4%
×100%=8.4%
答案:(1)8.8;(2)21.2(3)所得到的溶液中溶质的质量分数为8.4%.
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 名校课堂系列答案
名校课堂系列答案【题目】某混合气体N可能是由H2、CO、CO2中的一种或两种组成.为了解组成情况,某同学设计了如下装置进行实验(假设NaOH溶液可以完全吸收CO2): 
请根据下表中的实验,完成①、②、③、④中的内容.
可能出现的实验现象 | 气体N的组成 | |||
X中液体 | Y中黑色粉末 | Z中液体 | ||
(1) | 不浑浊 | 变成光亮的红色 | 不浑浊 | |
(2) | 变浑浊 | 变成光亮的红色 | CO和CO2 | |
(3) | 变浑浊 | 不浑浊 | CO2 | |
(4) | 变成光亮的红色 | 不浑浊 | H2和CO2 | |