题目内容
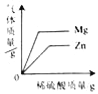
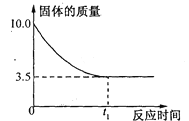
【题目】某一研究性学习小组为测定某铜锌合金的成分,取10 g该合金经粉碎后放入烧杯中,再加入93.7 g质量分数为20%的稀硫酸(反应后硫酸有剩余)。反应过程中烧杯内固体物质的质量与反应时间的关系如下图所示。请回答下列问题:
(1)将合金粉碎的目的是______________。
(2)10 g该合金中铜的质量为_______g。
(3)充分反应后产生氢气的质量是多少?
【答案】(1)使其充分反应;(2)3.5;(3)0.2 g
【解析】 (1) 将合金粉碎的目的是增大反应物接触面积,增大反应速率,并且能使反应更充分。(2)铜不与硫酸反应,锌能与硫酸反应的硫酸锌溶液和氢气,因此剩余固体就是铜,所以合金中铜的质量为3.5g;(3)解:由图像可以看出合金中锌的质量为6.5 g。设充分反应后产生氢气的质量为x,反应后生成硫酸锌的质量为y。
Zn+H2SO4===ZnSO4+H2↑
65 2
6.5g x
65/2=6.5g/x x=0.2 g
答:充分反应后产生氢气的质量为0.2 g。

练习册系列答案
相关题目
【题目】小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量/g | 10.8 | 9.6 | 8.1 | 8.1 |
试计算:
(1)完全反应后生成二氧化碳的质量为____________g;
(2)求该珍珠粉中碳酸钙的质量分数为____________。