题目内容
金属材料是工农业生产和人民生活离不开的材料之一,人类每年要从自然界获取大量的金属材料资源,根据你对金属和金属材料的认识,请回答(1)用赤铁矿为原料和碳炼铁的化学方程式 .
(2)铝制品在空气中有较强的抗腐蚀性,原因是 .
(3)保护金属资源的途径有:① ;②回收利用废旧金属;③合理有效地开采矿物;以及寻找金属代用品等.
(4)在AgNO3和Al(NO3)3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀硫酸,有气泡产生,则滤出的固体中一定含有 .
【答案】分析:(1)赤铁矿的主要成分为氧化铁,所以可以据此写出该反应的化学方程式;
(2)根据铝的化学性质较活泼来进行分析并得出原因;
(3)根据能够保护金属的方法和途径来解答;
(4)根据金属活动性顺序及其应用来分析并解答.
解答:解:(1)赤铁矿石的主要成分为氧化铁,在用赤铁矿石冶炼铁时所发生的反应为氧化铁和一氧化碳的反应,故可以写出该反应的化学方程式;
(2)铝的化学性质比较活泼在常温下可以和氧气反应而生成氧化铝薄膜,从而阻止了进一步氧化,而使铝制品具有较强的抗腐蚀性;
(3)根据保护金属的措施可以知道,防止金属的锈蚀是一项非常重要的保护金属的措施;
(4)铁的活动性比铜的强,比铝的弱,所以若向硝酸银和硝酸铝溶液中加入铁粉,铁会和硝酸银反应生成银单质,但是银不能和酸反应,根据题给的信息可知加入了稀硫酸后生成了气体,可以知道开始加入的铁粉是过量的,即把银全部置换出后铁仍然有剩余,从刚才的分析可以知道滤出的固体中一定含有铁和银.
故答案为:(1)Fe2O3+3CO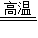 2Fe+3CO2;
2Fe+3CO2;
(2)铝的化学质较活泼,在常温下即可与空气中的氧气反应,在表面生成致密的氧化铝薄膜,防止铝进一步被氧化;
(3)防止金属腐蚀;
(4)银和铁.
点评:熟记金属活动性顺序及其应用,能够根据金属活动性应用来判断置换反应能否发生,熟记炼铁的反应原理,记住化学方程式:Fe2O3+3CO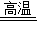 2Fe+3CO2.
2Fe+3CO2.
(2)根据铝的化学性质较活泼来进行分析并得出原因;
(3)根据能够保护金属的方法和途径来解答;
(4)根据金属活动性顺序及其应用来分析并解答.
解答:解:(1)赤铁矿石的主要成分为氧化铁,在用赤铁矿石冶炼铁时所发生的反应为氧化铁和一氧化碳的反应,故可以写出该反应的化学方程式;
(2)铝的化学性质比较活泼在常温下可以和氧气反应而生成氧化铝薄膜,从而阻止了进一步氧化,而使铝制品具有较强的抗腐蚀性;
(3)根据保护金属的措施可以知道,防止金属的锈蚀是一项非常重要的保护金属的措施;
(4)铁的活动性比铜的强,比铝的弱,所以若向硝酸银和硝酸铝溶液中加入铁粉,铁会和硝酸银反应生成银单质,但是银不能和酸反应,根据题给的信息可知加入了稀硫酸后生成了气体,可以知道开始加入的铁粉是过量的,即把银全部置换出后铁仍然有剩余,从刚才的分析可以知道滤出的固体中一定含有铁和银.
故答案为:(1)Fe2O3+3CO
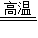 2Fe+3CO2;
2Fe+3CO2;(2)铝的化学质较活泼,在常温下即可与空气中的氧气反应,在表面生成致密的氧化铝薄膜,防止铝进一步被氧化;
(3)防止金属腐蚀;
(4)银和铁.
点评:熟记金属活动性顺序及其应用,能够根据金属活动性应用来判断置换反应能否发生,熟记炼铁的反应原理,记住化学方程式:Fe2O3+3CO
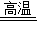 2Fe+3CO2.
2Fe+3CO2. 
练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目