题目内容
某校化学研究性学习小组的同学对一瓶敞口放置的氢氧化钠产生了兴趣,甲乙两组同学围绕这瓶氢氧化钠进行了一系列的探究活动.
【提出问题】①氢氧化钠是否完全变质②样品中碳酸钠的质量分数是多少?
【查阅资料】①氢氧化钠与二氧化碳反应生成碳酸钠和水
②向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应;
【设计实验】实验一:探究氢氧化钠固体的变质情况
①取少量该固体样品置于试管中,向其中加入稀盐酸,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则反应方程式为
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.请将下表填写完整.
实验二:测定其中碳酸钠的质量分数
【设计方案】
①甲组同学:称取16.40g样品,放入过量的盐酸直到反应停止,共收集到4.40g二氧化碳.(设计思路:根据样品与盐酸反应生成二氧化碳的质量求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.)
②乙组同学:称取16.40g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.(设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.)
【解决问题】根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:
【交流与反思】
(1)在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:
小明又重新设计新方案:先用电子秤准确称取16.40g变质的NaOH样品放入锥形瓶中,用电子秤秤得锥形瓶及样品的总质量为51.40g,再把175.00g 7.3%稀盐酸平均分成7份依次加入样品中,每次充分反应用电子秤秤得锥形瓶及所盛物质的质量,实验数据记录如下:
(2)请根据上述实验数据,计算样品中氢氧化钠的质量分数为
【提出问题】①氢氧化钠是否完全变质②样品中碳酸钠的质量分数是多少?
【查阅资料】①氢氧化钠与二氧化碳反应生成碳酸钠和水
②向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应;
【设计实验】实验一:探究氢氧化钠固体的变质情况
①取少量该固体样品置于试管中,向其中加入稀盐酸,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则反应方程式为
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
.②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.请将下表填写完整.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液, 充分反应后过滤 |
白色沉淀 白色沉淀 |
有关反应的化学方程式为 Na2CO3+CaCl2=2NaCl+CaCO3↓ Na2CO3+CaCl2=2NaCl+CaCO3↓ |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入 酚酞试液 酚酞试液 |
变红 变红 |
该样品中含有氢氧化钠 |
【设计方案】
①甲组同学:称取16.40g样品,放入过量的盐酸直到反应停止,共收集到4.40g二氧化碳.(设计思路:根据样品与盐酸反应生成二氧化碳的质量求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.)
②乙组同学:称取16.40g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.(设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.)
【解决问题】根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:
设碳酸钠质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
样品中碳酸钠的质量分数=
×100%=64.6%
答:样品中碳酸钠的质量分数64.6%.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
样品中碳酸钠的质量分数=
| 10.6g |
| 16.40g |
答:样品中碳酸钠的质量分数64.6%.
设碳酸钠质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
样品中碳酸钠的质量分数=
×100%=64.6%
答:样品中碳酸钠的质量分数64.6%.
.(任选一组数据进行计算,写出过程)Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
样品中碳酸钠的质量分数=
| 10.6g |
| 16.40g |
答:样品中碳酸钠的质量分数64.6%.
【交流与反思】
(1)在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:
样品中有水,无法测出样品的氢氧化钠的质量
样品中有水,无法测出样品的氢氧化钠的质量
小明又重新设计新方案:先用电子秤准确称取16.40g变质的NaOH样品放入锥形瓶中,用电子秤秤得锥形瓶及样品的总质量为51.40g,再把175.00g 7.3%稀盐酸平均分成7份依次加入样品中,每次充分反应用电子秤秤得锥形瓶及所盛物质的质量,实验数据记录如下:
| 加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | 第七次 |
| 锥形瓶及所盛物质的总质量 | 76.40 | 101.40 | 126.40 | 151.40 | 174.20 | 197.00 | 222.00 |
48.8%
48.8%
.(不要写出计算过程)分析:实验一:①根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行解答;
②根据氯化钙和碳酸钠反应生成碳酸钙白色沉底和氯化钠以及氢氧化钠能使酚酞试液变红进行解答;
实验二:【解决问题】根据产生二氧化碳的质量或者生成碳酸钙的质量求出碳酸钠的质量进而求出样品中碳酸钠的质量分数进行解答;
【交流与反思】(1)根据氢氧化钠具有吸水性,样品中除去碳酸钠不只有氢氧化钠还有水进行解答.
(2)根据盐酸先和氢氧化钠反应,没有气体生成,所以开始溶液质量不变,氢氧化钠反应完毕后盐酸再和碳酸钠反应生成二氧化碳气体,质量会减少进行解答.
②根据氯化钙和碳酸钠反应生成碳酸钙白色沉底和氯化钠以及氢氧化钠能使酚酞试液变红进行解答;
实验二:【解决问题】根据产生二氧化碳的质量或者生成碳酸钙的质量求出碳酸钠的质量进而求出样品中碳酸钠的质量分数进行解答;
【交流与反思】(1)根据氢氧化钠具有吸水性,样品中除去碳酸钠不只有氢氧化钠还有水进行解答.
(2)根据盐酸先和氢氧化钠反应,没有气体生成,所以开始溶液质量不变,氢氧化钠反应完毕后盐酸再和碳酸钠反应生成二氧化碳气体,质量会减少进行解答.
解答:解:实验一:①盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②氯化钙和碳酸钠反应生成碳酸钙白色沉底和氯化钠,氢氧化钠能使酚酞试液变红.
实验二:【解决问题】①设碳酸钠质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
样品中碳酸钠的质量分数=
×100%=64.6%
答:样品中碳酸钠的质量分数64.6%.
②设碳酸钠质量为y
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
y 10.00g
=
y=10.6g
样品中碳酸钠的质量分数=
×100%=64.6%
答:样品中碳酸钠的质量分数64.6%.
【交流与反思】(1)氢氧化钠具有吸水性,样品中除去碳酸钠不只有氢氧化钠还有水,故甲、乙两种方案都不妥;
(2)盐酸先和氢氧化钠反应,没有气体生成,所以开始溶液质量不变,氢氧化钠反应完毕后盐酸再和碳酸钠反应生成二氧化碳气体,质量会减少.
由题中数据分析可知,前四次溶液质量没有变化,所以前四次反应的盐酸和氢氧化钠消耗的.
氢氧化钠消耗盐酸的质量为175.00g×
=100.0g
设样品中氢氧化钠的质量为x.
NaOH+HCl=NaCl+H2O
40 36.5
x 100.Og×7.3%
=
x=8.0g
样品中氢氧化钠的质量分数=
×100%=48.8%
答:样品中氢氧化钠的质量分数为48.8%.
故答案为:实验一:①Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②白色沉淀;Na2CO3+CaCl2=2NaCl+CaCO3↓; 酚酞试液;变红;
实验二:【解决问题】解:设碳酸钠质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
样品中碳酸钠的质量分数=
×100%=64.6%
答:样品中碳酸钠的质量分数64.6%.
【交流与反思】(1)理由是:样品中有水,无法测出样品的氢氧化钠的质量;
(2)48.8%.
②氯化钙和碳酸钠反应生成碳酸钙白色沉底和氯化钠,氢氧化钠能使酚酞试液变红.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液, 充分反应后过滤 |
白色沉淀 | 有关反应的化学方程式为 Na2CO3+CaCl2=2NaCl+CaCO3↓ |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入酚酞试液 | 变红 | 该样品中含有氢氧化钠 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
样品中碳酸钠的质量分数=
| 10.6g |
| 16.40g |
答:样品中碳酸钠的质量分数64.6%.
②设碳酸钠质量为y
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
y 10.00g
| 106 |
| y |
| 100 |
| 10.00g |
y=10.6g
样品中碳酸钠的质量分数=
| 10.6g |
| 16.40g |
答:样品中碳酸钠的质量分数64.6%.
【交流与反思】(1)氢氧化钠具有吸水性,样品中除去碳酸钠不只有氢氧化钠还有水,故甲、乙两种方案都不妥;
(2)盐酸先和氢氧化钠反应,没有气体生成,所以开始溶液质量不变,氢氧化钠反应完毕后盐酸再和碳酸钠反应生成二氧化碳气体,质量会减少.
由题中数据分析可知,前四次溶液质量没有变化,所以前四次反应的盐酸和氢氧化钠消耗的.
氢氧化钠消耗盐酸的质量为175.00g×
| 4 |
| 7 |
设样品中氢氧化钠的质量为x.
NaOH+HCl=NaCl+H2O
40 36.5
x 100.Og×7.3%
| 40 |
| x |
| 36.5 |
| 100.0g×7.3% |
x=8.0g
样品中氢氧化钠的质量分数=
| 8.0g |
| 16.4g |
答:样品中氢氧化钠的质量分数为48.8%.
故答案为:实验一:①Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②白色沉淀;Na2CO3+CaCl2=2NaCl+CaCO3↓; 酚酞试液;变红;
实验二:【解决问题】解:设碳酸钠质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
样品中碳酸钠的质量分数=
| 10.6g |
| 16.40g |
答:样品中碳酸钠的质量分数64.6%.
【交流与反思】(1)理由是:样品中有水,无法测出样品的氢氧化钠的质量;
(2)48.8%.
点评:利用质量守恒计算反应后溶液质量比较直观:反应既不产生气体又无沉淀,反应后所得溶液质量即为反应前两溶液的质量和.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是 ,碳酸钠的质量分数是 .(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质 (填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
表中数据a= g,b= g.并请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.
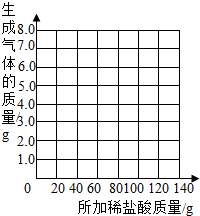
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |

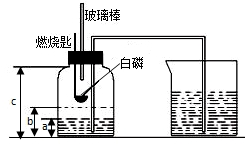 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: