题目内容
(2013?广阳区一模)过氧化钠(Na2O2)与水发生反应,生成氢氧化钠和氧气,现将78g过氧化钠放入338g水中,充分反应.试计算所得溶液中溶质质量分数是多少?
分析:根据过氧化钠(Na2O2)与水发生反应可以知道,反应后的溶液为氢氧化钠溶液,可以根据过氧化钠的质量结合化学方程式求算出氢氧化钠的质量氧气的质量,进而求算出氢氧化钠溶液的质量溶质质量分数.
解答:解:设生成的氢氧化钠的质量为x,氧气的质量为y
2Na2O2+2H2O=4NaOH+O2↑
156 160 32
78g x y
=
解得:x=80g
=
解得:y=16g
所得溶液中溶质质量分数是:
×100%=20%
答:所得溶液中溶质质量分数是20%.
2Na2O2+2H2O=4NaOH+O2↑
156 160 32
78g x y
| 156 |
| 160 |
| 78g |
| x |
| 156 |
| 32 |
| 78g |
| y |
所得溶液中溶质质量分数是:
| 80g |
| 78g+338g-16g |
答:所得溶液中溶质质量分数是20%.
点评:根据反应的化学方程式进行计算时,所使用的物质的质量必须为完全反应的物质的质量,未参加反应的物质质量不能代入化学方程式进行计算.

练习册系列答案
相关题目
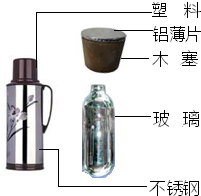 (2013?广阳区一模)(1)右图标出的是有关热水瓶的组成物质,请回答下列问题.
(2013?广阳区一模)(1)右图标出的是有关热水瓶的组成物质,请回答下列问题.