题目内容
元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
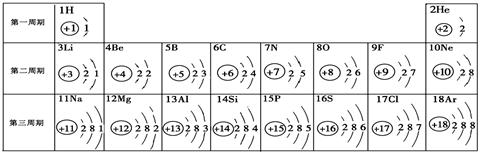
⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
⑵ 元素的化学性质与原子结构中的______________数关系密切;
⑶ 在同一族中,各元素的原子结构呈现的规律有________________ (任写一点);
⑷ 研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。

⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
⑵ 元素的化学性质与原子结构中的______________数关系密切;
⑶ 在同一族中,各元素的原子结构呈现的规律有________________ (任写一点);
⑷ 研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
⑴ 非金属 ;得 ; ⑵ 最外层电子 ;
⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷ 逐渐减小
⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷ 逐渐减小
试题分析:⑴第16号元素为硫元素,最外层电子数为6,容易从外界得到两个电子而达到稳定状态;⑵最外层电子数决定了元素的化学性质;⑶在同一族中,各元素的原子结构呈现的规律较多,言之有理即可,比如电子层数递增或最外层电子数相等或从上到下核电荷数增大等;⑷第三周期从11~17号元素核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。
点评:原子结构示意图属于中考中的热点题型,出现率较高,但是并不难,注意仔细审题。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目


 5.6__________________________ ;( )反应;
5.6__________________________ ;( )反应;