题目内容
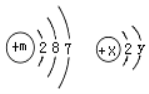
【题目】在一个密闭容器内有M、N、X、Y四种物质,在一定条件下反应一段时间后,测得反应前后各物质的质量如下:
物质 | M[ | N | X | Y |
反应前质量/g | 8 | 11 | 18 | 10 |
反应后质量/g | 8 | 23 | 4 | 待测 |
问:(1)待测数值为______ 。
(2)参与反应的X与Y的质量之比为________ 。
(3)反应中M可能是________(反应物、生成物、催化剂)。
(4)此反应的基本类型是_____ ,写一个相同类型的反应方程式_____________
【答案】12 7:1 催化剂 分解反应 2KMnO4![]() K2MnO4+MnO2+O2↑等
K2MnO4+MnO2+O2↑等
【解析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
(1)待测数值为:8+11+18+10-8-23-4=12;
(2)参与反应的X与Y的质量之比为:(18g-4g):(12g-10g)=7:1;
(3)反应前后M质量不变,可能是催化剂,也可能既不是催化剂也不是反应物和生成物;(4)反应后N质量增大,是生成物,Y质量增大,是生成物,X质量减小,是反应物,该反应属于分解反应;高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,属于分解反应,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。

 名校课堂系列答案
名校课堂系列答案【题目】某同学为了湖定石次有样品中碳酸钙的质最分数,取四份样品分别和稀盐酸反应,其实验数据记录如下表。(杂质既不溶于水也不跟酸反应)
第1份 | 第2份 | 第3份 | 第4份 | |
取样品质景 | 6.0 | 6.0 | 6.0 | 6.0 |
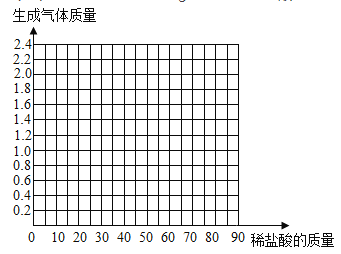
取稀盐酸质量(g) | 10.0 | 20.0 | 30.0 | 40.0 |
产生气体质量(g) | 0.88 | 1.76 | 2.2 | m |
通过对数据的分析和比较,回答下列有关问题:
(1)在第1份样品的实验中, ____________(填物质)完全反应了。
(2)m为____________
(3)石灰石样品中碳酸钙的质量分数是多少______?(请写出计算过程)
(4)请在图中面出在6.0g样品中加稀盐酸的质量与产生气体质量变化关系的示意图______。