题目内容
如图1所示为实验室制取气体的发生装置,适用于液体和固体反应或液体和液体反应制取气体,该装置的优点在于通过活塞控制液体的加入量,从而控制生成气体的速度和总量,达到随开随制,随关随停的效果.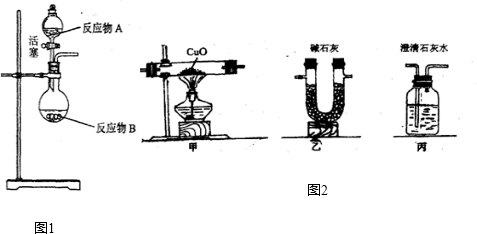
试根据该装置的特点回答下列问题:
(1)已知浓硫酸具有很强的吸水性,溶于水放出大量热量.某同学用浓硫酸和浓盐酸制取HCl气体,则反应物A应为
(2)已知氨气极易溶于水,常温常压下1体积水中大约能溶解700体积的氨气,所得的水溶液称为氨水,发生如下反应:
NH3+H2O
NH3?H2O
NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为
(3)草酸晶体与浓硫酸共热可得CO2、CO和水蒸气的混合气体,化学方程式如下:H2C2O4
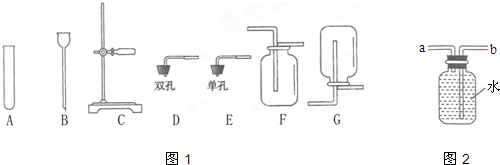
CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和

试根据该装置的特点回答下列问题:
(1)已知浓硫酸具有很强的吸水性,溶于水放出大量热量.某同学用浓硫酸和浓盐酸制取HCl气体,则反应物A应为
浓硫酸
浓硫酸
(填浓硫酸或浓盐酸).(2)已知氨气极易溶于水,常温常压下1体积水中大约能溶解700体积的氨气,所得的水溶液称为氨水,发生如下反应:
NH3+H2O
| 大部分 |
| 小部分 |
NaOH
NaOH
固体,用该方法制取氨气的原理为氨水
氨气+水
| NaOH溶解放热 |
氨水
氨气+水
(用文字表述).| NaOH溶解放热 |
(3)草酸晶体与浓硫酸共热可得CO2、CO和水蒸气的混合气体,化学方程式如下:H2C2O4
| H2SO4 |
| △ |
带导管的橡皮塞
带导管的橡皮塞
.某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是检验二氧化碳是否被完全吸收
检验二氧化碳是否被完全吸收
.分析:(1)根据浓硫酸溶于水放出大量热量分析;
(2)根据氢氧化钠溶于浓氨水放出大量的热,在热量作用下会有大量氨气生成;
(3)根据草酸晶体与浓硫酸共热制的混合气体,所用到的仪器有试管、酒精灯、铁架台(含铁夹)、带导管的橡皮塞分析;根据碱石灰的主要成分是CaO和NaOH,澄清石灰水可以检验二氧化碳的存在,一氧化碳通过灼热的氧化铜可以生成二氧化碳分析解题.
(2)根据氢氧化钠溶于浓氨水放出大量的热,在热量作用下会有大量氨气生成;
(3)根据草酸晶体与浓硫酸共热制的混合气体,所用到的仪器有试管、酒精灯、铁架台(含铁夹)、带导管的橡皮塞分析;根据碱石灰的主要成分是CaO和NaOH,澄清石灰水可以检验二氧化碳的存在,一氧化碳通过灼热的氧化铜可以生成二氧化碳分析解题.
解答:解:(1)浓硫酸溶于水放出大量热量,为防止酸液飞溅,可将密度大的液体倒入密度小的液体中,所以反应物A应该是浓硫酸.
故答案为:浓硫酸.
(2)氢氧化钠溶于浓氨水,因为氢氧化钠溶于水放出大量热,NH3?H2O不稳定,受热条件下易分解放出氨气,所以会有大量氨气逸出,所以反应物B为NaOH固体;用该方法制取氨气的原理为:氨水
氨气+水.
故答案为:NaOH;氨水
氨气+水.
(3)草酸晶体与浓硫酸共热制的混合气体,所用到的仪器有试管、酒精灯、铁架台(含铁夹)、带导管的橡皮塞;碱石灰的主要成分是CaO和NaOH,可以吸收二氧化碳和水,所以通过乙之后,混合气体中的二氧化碳和水蒸气都被吸收,为防止影响下面的实验结果,再通过丙是为了检验二氧化碳是否被完全吸收.
故答案为:带导管的橡皮塞;检验二氧化碳是否被完全吸收.
故答案为:浓硫酸.
(2)氢氧化钠溶于浓氨水,因为氢氧化钠溶于水放出大量热,NH3?H2O不稳定,受热条件下易分解放出氨气,所以会有大量氨气逸出,所以反应物B为NaOH固体;用该方法制取氨气的原理为:氨水
| NaOH溶解放热 |
故答案为:NaOH;氨水
| NaOH溶解放热 |
(3)草酸晶体与浓硫酸共热制的混合气体,所用到的仪器有试管、酒精灯、铁架台(含铁夹)、带导管的橡皮塞;碱石灰的主要成分是CaO和NaOH,可以吸收二氧化碳和水,所以通过乙之后,混合气体中的二氧化碳和水蒸气都被吸收,为防止影响下面的实验结果,再通过丙是为了检验二氧化碳是否被完全吸收.
故答案为:带导管的橡皮塞;检验二氧化碳是否被完全吸收.
点评:解决此题要了解浓硫酸溶于水的特点,氢氧化钠溶于水的特点,以及二氧化碳、碱石灰的特点等,有一定的难度.

练习册系列答案
相关题目


 NH3?H2O
NH3?H2O NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为______固体,用该方法制取氨气的原理为______(用文字表述).
NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为______固体,用该方法制取氨气的原理为______(用文字表述).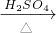 CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和______.某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是______.
CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和______.某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是______.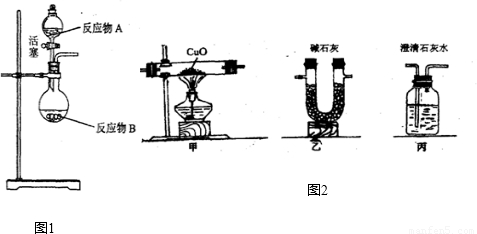
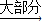 NH3?H2O
NH3?H2O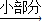 NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为 固体,用该方法制取氨气的原理为 (用文字表述).
NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为 固体,用该方法制取氨气的原理为 (用文字表述).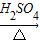 CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和 .某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是 .
CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和 .某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是 .