题目内容
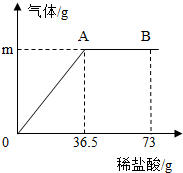
某纯碱样品中含有少量的氯化钠杂质。现称取6g该纯碱样品放在烧杯中并滴加稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试回答:
(1)A点产生气体的质量m = 。
(2)B点时,烧杯内溶液中的溶质是 (写出化学式)。
(3)A点时溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
⑴ m = 2.2g ⑵ NaCl HCl (3)16.3%
解析试题分析:⑴根据题意,碳酸钠与盐酸反应,生成氯化钠、水和二氧化碳,由于反应产生的气体二氧化碳全部逸出,故反应后烧杯内物质的总质量变小,根据质量守恒定律可知,减少的质量即为生成的二氧化碳的质量。结合图象可知,A点时碳酸钠与盐酸恰好完全反应,故A点时产生气体的质量m=反应物的总质量-反应后各物质的总质量=6g+36.5g-40.3g=2.2g。
⑵结合图象可知,由于B点时盐酸有剩余,故B点时,烧杯内溶液中的溶质是反应生成的NaCl和剩余的HCl。
⑶根据题意书写化学反应的方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑,由此可知,恰好完全反应时所得溶液中溶质是氯化钠,包括原混合物中的氯化钠(根据二氧化碳的质量求出碳酸钠的质量,再用混合物的质量-碳酸钠的质量)和反应生成的氯化钠(根据二氧化碳的质量可求出),最后根据溶质的质量分数= ×100%计算即可。
×100%计算即可。
解:设原样品中含碳酸钠质量为x,反应生成氯化钠质量为y
Na2CO3 + 2HCl = 2NaCl+ H2O + CO2↑
106 117 44
x y 2.2g

解得x=5.3g y=5.85g
则恰好完全反应时,溶液中NaCl的质量为=(6g-5.3g)+5.85g=6.55g
所以恰好完全反应时所得NaCl 溶液溶质的质量分数= ×100%=16.3%。
×100%=16.3%。
答: A点时溶液中溶质的质量分数为16.3%。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的识图能力和数据分析能力,解题的关键是根据图像找出恰好完全反应时,生成气体的质量,再利用相关的化学反应,并依据已知量对未知的应求量进行求解计算即可,对于反应后的溶质的计算要注意其组成来自于原混合物和反应生成的两部分。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案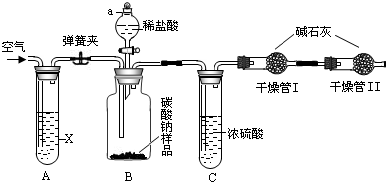
 某纯碱样品中含有少量的氯化钠杂质.现称取6g该纯碱样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试回答:
某纯碱样品中含有少量的氯化钠杂质.现称取6g该纯碱样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试回答:
 如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:
如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算: (2013?贵港一模)某纯碱样品中含有少量的氯化钠杂质.现称取6g该纯碱样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试回答:
(2013?贵港一模)某纯碱样品中含有少量的氯化钠杂质.现称取6g该纯碱样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试回答: