题目内容
【题目】化学是一门以实验为基础的科学,请应用所学知识完成下列问题。
Ⅰ.请结合图示回答问题:
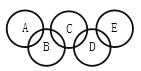
(1)仪器a的名称是_________。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式为________,选用的发生装置和收集装置的组合是_______(填序号),用该装置制取氧气时,需要改进的地方有______。
(3)实验室制取CO,可以用草酸(H2C2O4)固体和浓硫酸在加热条件下发生反应:H2C2O4 ![]() CO2↑+CO↑+H2O,则发生装置应选_______(填序号),收集CO时可用排水法,但不宜用排空气法的原因是_________。
CO2↑+CO↑+H2O,则发生装置应选_______(填序号),收集CO时可用排水法,但不宜用排空气法的原因是_________。
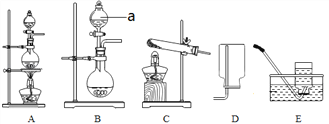
(4)为验证CO2气体中含有CO,某同学设计了如下图所示装置,并通过实验验证CO2气体中含有CO,根据图示回答下列问题。
装置F中发生反应的化学方程式为______________;装置G的作用是__________;能证明CO2气体中含有CO的现象是_______________。
Ⅱ.已知固体混合物M中可能含有Na2SO4、FeCl3、NaNO3、 BaCl2、CaCO3五种物质中的两种或多种。某化学课外活动小组为判断固体混合物M的成分,按下述步骤进行实验探究。(设过程中所有发生的反应都恰好完全反应)。
(1)取一定质量的该固体混合物M放入一洁净烧杯中,加足量的水,全部溶解,无沉淀。
(2)取一定质量的步骤(1)中所得溶液放入一洁净烧杯中,向其中加入适量的NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液C。
(3)另取一定质量的步骤(1)中所得溶液放入另一洁净烧杯中,向其中加入适量稀H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液E。
(4)将所得滤液C和滤液E充分混合,再向混合后的溶液中加入适量AgNO3溶液,待充分反应后,过滤,得白色沉淀F和滤液G。
请根据上述实验过程和发生的现象做出相应推理,填写以下空白:
①在固体混合物M里,上述五种物质中肯定存在的物质是(写化学式)______
②在滤液G中,含有的金属阳离子共有___种,该滤液中肯定存在的酸根离子是____。
③在混合物M里,上述五种物质中肯定不存在的物质是(写化学式)______。得出此结论的理由是___________。
【答案】 分液漏斗 2KMnO4![]() K2MnO4+MnO2+O2 ↑ CE 在C中的试管口放一小团棉花 A CO的密度与空气密度接近且有毒 CO2+2NaOH=Na2CO3+H2O 检验CO2是否除尽 I中黑色粉末变红,G中澄清石灰水不变浑浊而J中澄清石灰水变浑浊 FeCl3、BaCl2 1 NO3- Na2SO4、CaCO3 步骤(1)中全部溶解,无沉淀,而CaCO3不溶于水、BaCl2与Na2SO4反应有白色沉淀生成,不能共存
K2MnO4+MnO2+O2 ↑ CE 在C中的试管口放一小团棉花 A CO的密度与空气密度接近且有毒 CO2+2NaOH=Na2CO3+H2O 检验CO2是否除尽 I中黑色粉末变红,G中澄清石灰水不变浑浊而J中澄清石灰水变浑浊 FeCl3、BaCl2 1 NO3- Na2SO4、CaCO3 步骤(1)中全部溶解,无沉淀,而CaCO3不溶于水、BaCl2与Na2SO4反应有白色沉淀生成,不能共存
【解析】本题考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和盐的化学性质,物质的鉴别、推断等,综合性比较强;气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。物质的鉴别、推断根据特征反应分析。
Ⅰ(1)仪器a的名称是:分液漏斗;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2 ↑;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,选用的发生装置和收集装置的组合是CE;加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;
K2MnO4+MnO2+O2 ↑;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,选用的发生装置和收集装置的组合是CE;加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;
(3)实验室制取CO,可以用草酸(H2C2O4)固体和浓硫酸在加热条件下发生反应,因此发生装置应选A;收集CO时可用排水法,但不宜用排空气法的原因是:CO的密度与空气密度接近且有毒;
(4)装置F中发生反应是二氧化碳和氢氧化钠反应生成碳酸钠和水反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;装置G的作用是:检验CO2是否除尽;能证明CO2气体中含有CO的现象是:I中黑色粉末变红,G中澄清石灰水不变浑浊而J中澄清石灰水变浑浊;
Ⅱ由题目的信息可知;取一定质量的该固体混合物M放入一洁净烧杯中,加足量的水,全部溶解,无沉淀,说明一定没有碳酸钙,Na2SO4和BaCl2不能共存;取一定质量的步骤(1)中所得溶液放入一洁净烧杯中,向其中加入适量的NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液C,说明一定有氯化铁;(3)另取一定质量的步骤(1)中所得溶液放入另一洁净烧杯中,向其中加入适量稀H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液E,说明一定有氯化钡,一定没有硫酸钠;(4)将所得滤液C和滤液E充分混合,再向混合后的溶液中加入适量AgNO3溶液,盐酸和硝酸银反应生成氯化银白色沉淀和硝酸,氯化钠和硝酸银反应生成氯化银白色沉淀和硝酸钠;综上所述:
①在固体混合物M里,上述五种物质中肯定存在的物质是FeCl3、BaCl2 ;
②在滤液G中,含有的金属阳离子共有1种,该滤液中肯定存在的酸根离子是NO3-;
③在混合物M里,上述五种物质中肯定不存在的物质是Na2SO4、CaCO3,得出此结论的理由是步骤(1)中全部溶解,无沉淀,而 CaCO3 不溶于水、BaCl2与Na2SO4反应有白色沉淀生成,不能共存。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案