题目内容
【题目】锌是人体必需的的微量元素,称“生命元素”。
(1)【锌的广泛应用】
处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为。
(3)【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。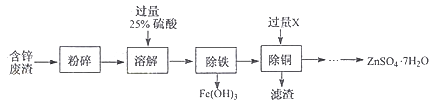
粉碎的目的是。
(4)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和 ,
(5)物质X是 , 滤渣中含有的金属单质有 ,
(6)流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑过滤、洗涤和低温烘干。
(7)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式。
(8)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。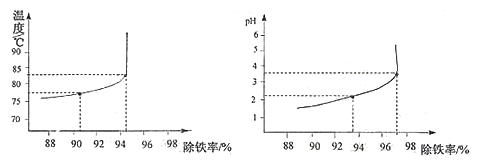
(9)【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验: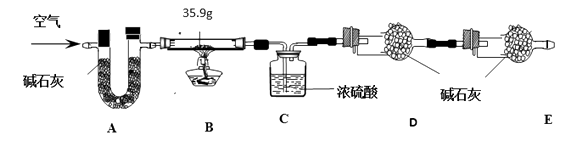
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ![]() ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2 ![]() ZnO+H2O。
ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
装置A的作用是。
(10)若没有E装置,测得二氧化碳的质量(填“偏大”、“偏小”或“无影响”)。
(11)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c = 。
(12)【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:。
【答案】
(1)侏儒,B
(2)Zn+H2SO4=ZnSO4+H2↑
(3)增大接触面积,使反应更快更充分
(4)22.7mL,胶头滴管
(5)Zn,Zn、Cu
(6)蒸发浓缩
(7)Fe3O4
(8)83±1,3.5±0.1
(9)除去空气中的CO2 和H2O
(10)偏大
(11)1∶2∶2
(12)ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑
【解析】解:(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。 缺乏严重时,将会导致“侏儒症”和智力发育不良。贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指元素;(2)锌与稀硫酸,生成硫酸锌和氢气。反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;(3)粉碎的目的是增大接触面积,使反应更快更充分;(4)用98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为x,则x×1.84g/ml×98%=200g×25%,x≈22.7ml; 需要的玻璃仪器有量筒﹑玻璃棒、烧杯和胶头滴管;(5)除铁后的溶液中含有硫酸铜和硫酸锌,要除掉铜,得硫酸锌溶液,所以加入的金属X是锌,滤渣中的金属有反应生成的铜和过量的锌;(6)要通过降温结晶得到七水硫酸锌,则应该先将溶液加热浓缩,然后再降温结晶;(7)设铁的氧化物的化学式为FexOy;56x/16y=21:8, x/y=3/4,所以氧化物为Fe3O4;除铁过程中,温度、pH对除铁效果的影响分别对如图所示。(8)由图可知,除铁时温度应控制在83±1 ℃为宜,pH应控制在3.5±0.1℃为宜;(9)装置A中碱石灰是氢氧化钠和氧化钙的混合物,能吸收水和二氧化碳,装置A的作用是除去空气中的CO2 和H2O ;(10)若没有E装置,D中的碱石灰能吸收空气中的水和二氧化碳,使测得二氧化碳的质量偏大;(11)装置C增加的量为水的质量,和装置D增加的为二氧化碳的质量,所以反应生成7.2 g水和4.4 g二氧化碳。aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2,据质量守恒定律可知反应前后物质的总质量不变,可知生成氧化锌的总质量为35.9g-7.2g-4.4g=24.3g;
设碳酸锌分解生成氧化锌的质量为x
ZnCO3 | ZnO+ | CO2↑ |
81 | 44 | |
x | 4.4g |
81/x=44/4.4g x=8.1g
则有氢氧化锌分解生成氧化锌的质量为24.3g-8.1g=16.2g,
设氢氧化锌分解生成水的质量为y
Zn(OH)2 | ZnO+ | H2O |
81 | 18 | |
16.2g | y |
81/16.2g=18/y , y=3.6g,
所以35.9g aZnCO3·bZn(OH)2·cH2O中结晶水的质量为7.2g-3.6g=3.6g,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =1:2:2;
所以答案是:(1)侏儒,B;(2)Zn+H2SO4=ZnSO4+H2↑;(3)增大接触面积,使反应更快更充分;(4)22.7ml;胶头滴管;(5)Zn;Zn、Cu;(6)蒸发浓缩;(7)Fe3O4;(8)83±1;3.5±0.1;(9)除去空气中的CO2 和H2O;(10)偏大;(11)1∶2∶2;(12)ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑。
【考点精析】根据题目的已知条件,利用书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比.

 53随堂测系列答案
53随堂测系列答案
