题目内容
【题目】根据下列装置图回答问题:
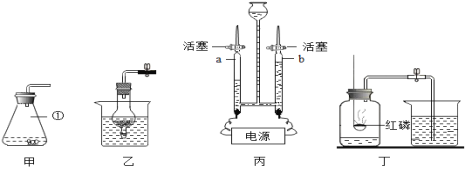
(1)装置甲中仪器①的名称是_______。实验室用装置甲制取二氧化碳的化学方程式为_______。装置乙也可用于实验室制取二氧化碳,与装置甲相比,装置乙的优点是_______。
(2)用装置丙电解水时,a管连接电源的_______极,a、b两管中气体的体积比约为_______。
(3)用装置丁测定空气中氧气的含量,红磷燃烧时的现象为_______,该实验还可说明氮气具有的化学性质是_______。
【答案】锥形瓶 CaCl2+2HCl=CaCl2+H2O+CO2↑ 能控制反应的发生与停止 负 2:1 剧烈燃烧,产生大量白烟,放出热量 氮气既不能燃烧,也不支持燃烧(氮气难溶于水)
【解析】
(1)装置甲中仪器①的名称是锥形瓶;实验室制取二氧化碳所用的反应物为石灰石或大理石和盐酸,石灰石或大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成是氯化钙、水和二氧化碳,反应的化学方程式为:CaCl2+2HCl=CaCl2+H2O+CO2↑;在乙装置中,加入药品反应后,关闭活塞,球形干燥管内的气压增大,液面下降,固体与液体脱离接触,反应停止,打开活塞,球形干燥管内的气压降低,液面上升,固体与液体接触,反应进行。乙装置的优点是能控制反应的发生与停止;
(2)在电解水的过程中,生成氢气与氧气的体积之比为:2:1,电源正极产生的氧气,负极产生的是氢气,故a管连接电源的负极;
(3)红磷燃烧时的现象是:剧烈燃烧,产生大量白烟,放出热量;红磷燃烧把氧气耗尽,剩余的成分主要是氮气,说明了氮气既不能燃烧,也不支持燃烧;水被倒吸入集气瓶中,剩余的气体中还主要是氮气,说明氮气难溶于水

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目