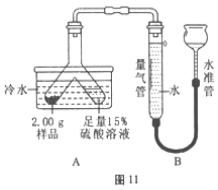
题目内容
【题目】化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生,是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了。
【分析】氢氧化钠变质的原因是_______________________________________(用化学方程式表示)。
【提出问题1】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3==2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性。
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论。
实验步骤 | 实验现象 | 实验结论 |
(1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡。 | 有白色沉淀产生。 | 说明原溶液中一定含有 _____________。 |
(2)取(1)试管中的上层清液滴加酚酞试液。 | 溶液变红色。 | 则溶液中一定含有__________。 |
【实验结论】同学得出的结论是:氢氧化钠溶液_______________变质(填“部分”或“全部”)。
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的______________________。
(2)借助于_____________________可判断盐酸和氢氧化钠溶液恰好完全反应。
[提出问题2]该溶液的变质程度如何呢?
实验步骤:取该溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,所加盐酸质量与产生气体质量关系如图:

试计算:生成气体m的值_________________(请写出解题过程)。
【答案】 2NaOH+CO2=Na2CO3+H2O Na2CO3 NaOH 部分 Ca(OH)2或Ba(OH)2 酚酞溶液 解: 与Na2CO3反应消耗盐酸溶质质量为 (60g-10g)×7.3%=3.65g
设生成二氧化碳的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
3.65g x
![]() =
=![]()
X=2.2g
答:生成二氧化碳的质量为2.2g
实验步骤 | 实验现象 | 实验结论 |
(1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡。 | 有白色沉淀产生。 | 说明原溶液中一定含有 Na2CO3 。 |
(2)取(1)试管中的上层清液滴加酚酞试液。 | 溶液变红色。 | 则溶液中一定含有NaOH 。 |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案