题目内容
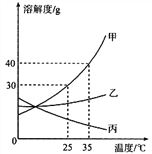
【题目】下图为甲、乙两种固体物质(不考虑结晶水) 的溶解度曲线。下列说法错误的是( )
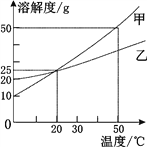
A. 20 ℃时,甲、乙具有相同的溶解度
B. 甲、乙的溶解度都随温度的升高而增大
C. 20 ℃时,可以配制溶质的质量分数为25%的甲溶液
D. 50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液先成为饱和溶液。
【答案】C
【解析】A、在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。由图可知20 ℃时,甲、乙具有相同的溶解度,正确;B. 甲、乙的溶解度都随温度的升高而增大 ,正确; C. 20 ℃时,甲的溶解度为25g,![]() =
=![]() <25%,不可以配制溶质的质量分数为25%的甲溶液,错误;D. 50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,由于温度高于20 ℃时,乙的溶解度比甲的小,则乙溶液先成为饱和溶液,正确。故选C。
<25%,不可以配制溶质的质量分数为25%的甲溶液,错误;D. 50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,由于温度高于20 ℃时,乙的溶解度比甲的小,则乙溶液先成为饱和溶液,正确。故选C。

 阅读快车系列答案
阅读快车系列答案【题目】某实验室用含硫酸铜和盐酸的混合液与混入了锌粉的铜粉(以下简称铜锌粉)反应来测定混合液中盐酸的质量分数和铜锌粉中锌的含量。操作如下:取200 g混合液于实验容器中,分五次加入铜锌粉,边加边搅拌,以保证盐酸和硫酸铜同时与锌充分反应。实验测得的相关数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入铜锌粉的累计质量/ g | 9 | 18 | 27 | 36 | 40 |
产生氢气的累计质量/ g | 0.1 | 0.2 | m | 0.4 | 0.4 |
容器中剩余固体的质量/ g | 5.71 | 11.42 | 17.13 | 22.84 | 26.84 |
(1)表中m的值为_____________。
(2)第四次加入铜锌粉并充分反应后,溶液中所含溶质的化学式为_____________。
(3)计算原混合液中盐酸的质量分数是多少_____________?(写出计算过程,结果精确到0.1%)
(4)通过计算可知,每9 g铜锌粉中含有_______________g锌粉。