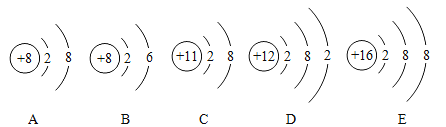题目内容
【题目】锰元素的相关信息如图所示。下列说法正确的是
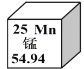
A. 属于非金属元素
B. 原子序数是25
C. 原子的核外电子数为54.94
D. 相对原子质量为54.94g
【答案】B
【解析】
A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是锰,带“钅”字旁,属于金属元素,故选项说法错误;B、根据元素周期表中的一格可知,左上角的数字为25,表示原子序数为25,故选项说法正确;C、根据元素周期表中的一格可知,左上角的数字为25,表示原子序数为25;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为25,故选项说法错误;D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为54.94,相对原子质量单位是“1”,不是“克”,故选项说法错误。故选B。

 新思维假期作业暑假吉林大学出版社系列答案
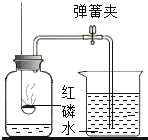
新思维假期作业暑假吉林大学出版社系列答案【题目】已知锌与硫酸可以发生反应生成硫酸锌和氢气。某研究性学习小组在探究“影响锌与硫酸反应快慢的因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快。
(查阅资料)①锌与硫酸反应的符号表达式Zn + H2SO4 = ZnSO4 + H2
②锌与硫酸铜溶液反应的符号表达式Zn + CuSO4 = ZnSO4 + Cu
③硫酸溶液中含有H+、硫酸根离子(用化学用语表示_____________);硫酸铜溶液中含有Cu2+、硫酸根离子;硫酸锌溶液中含有Zn2+、硫酸根离子。
(提出问题)是什么离子导致产生氢气的速率加快?
(猜想假设)甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是_________。
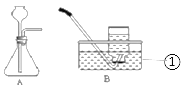
(实验验证)写出仪器①的名称__________。用A、B两组仪器进行实验:
步骤一:检查装置气密性。连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察到_______,即为气密性良好。
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL。称取2份形状相同锌粒各1g,分别与以上溶液反应。反应装置如图A所示。用此装置实验时,长颈漏斗下端要插入液面以下,目的是__________。
步骤三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如下表),什么时间开始收集气体?__________。(填“气泡连续均匀”或“刚有气泡”)
编号 | 20%的稀硫酸各20mL | 锌粒 | 收集1瓶氢气所需的时间 |
① | 加入质量分数为10%的硫酸铜溶液1mL | 1g | 2分10秒 |
② | 加入质量分数为10%的硫酸锌溶液1mL | 1g | 3分01秒 |
(得出结论)硫酸中混有硫酸铜溶液时,产生氢气的速率加快与__________有关。实验②中加入质量分数为10%的硫酸锌溶液1mL的作用是__________。
(反思质疑)丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是__________。
(继续探究)请你设计一个实验方案验证丁同学的观点是否正确。
编号 | 实验步骤 | 实验现象比较 | 实验结论 |
① | 取1g锌粒于锥形瓶中, 加入20mL 20%的稀硫酸 | __________ | 产生氢气的速率较快与铜单质有关 |
② | __________ |
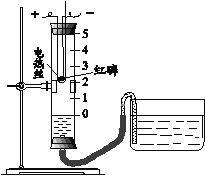
【题目】利用下图装置进行空气中氧气含量测定实验。
实验装置 | 实验操作 |
| I.向玻璃管和水槽内加适量的水,在燃烧匙里放足量红磷,塞紧塞子,上下移动水槽至两边水面相平于玻璃管的零刻度位置。 II.接通电源,待红磷燃烧,断开电源。 III.当温度恢复至室温,水不再进入玻璃管时,上下移动水槽至两边水面相平。 |
(1)实验中加入足量红磷的目的是_________。
(2)实验结束后,观察到的现象是_________。
(3)实验操作I、III中,上下移动水槽至两边水面相平的目的是________。