题目内容
【题目】Fe2O3在一定条件下可转化为FeO:Fe2O3+CO ![]() 2FeO +CO2 , 反应前Fe2O3的质量为160克,反应过程中,Fe2O3的转化率(参加反应的Fe2O3与反应前的Fe2O3的质量比)用a表示,固体中铁元素与氧元素的质量比用mFe/m Fe0表示.
2FeO +CO2 , 反应前Fe2O3的质量为160克,反应过程中,Fe2O3的转化率(参加反应的Fe2O3与反应前的Fe2O3的质量比)用a表示,固体中铁元素与氧元素的质量比用mFe/m Fe0表示.
(1)填写下表中的空格:
mFe/m 0 | 7/3 | 14/5 | 7/2 |
固体成份 | Fe2O3 | Fe2O3、FeO | |
转化率(α) | 0 | 100% |
(2)如果Fe2O3转让为FeO 的反应分两步进行:3Fe2O3+CO ![]() 2Fe3O4+CO2 Fe304+3CO
2Fe3O4+CO2 Fe304+3CO ![]() 2FeO+CO2反应后的固体中mFe/mO═21/8时固体的成分可能有三种情况:
2FeO+CO2反应后的固体中mFe/mO═21/8时固体的成分可能有三种情况:
①Fe3O4;
②(填化学式、下同);
(3) .
【答案】
(1)FeO;50%
(2)Fe2O3和FeO
(3)Fe3O4、Fe2O3和FeO
【解析】解:(1)根据Fe2O3+C0 ![]() 2FeO +CO 2 , Fe2O3的转化率是参加反应的Fe2O3与反应前的Fe2O3的质量比, 由表格中的转化率为100%可知,氧化铁全部反应,
2FeO +CO 2 , Fe2O3的转化率是参加反应的Fe2O3与反应前的Fe2O3的质量比, 由表格中的转化率为100%可知,氧化铁全部反应,
则固体成分为FeO,氧化亚铁中Fe、O元素的质量比为56:16=7:2,符合题意;
当中mFe/mO═14/5时,设参加反应的氧化铁的质量为x,则
Fe2O3+CO | 2FeO +CO 2 , |
160 | 144 |
x |
|
由反应后铁与氧元素的质量比得,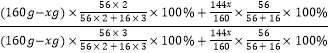 =
= ![]() ,
,
解得x=80g,
则转化率为 ![]() ×100%=50%,
×100%=50%,
所以答案是:FeO;50%;(2)由反应可知,反应后的固体有四氧化三铁、也可能有氧化亚铁,若只有四氧化三铁,在Fe3O4中,铁、氧元素的质量比为56×3:16×4=21:8,则可能反应后固体只有四氧化三铁;
在Fe2O3中铁、氧元素的质量比为56×2:16×3=7:3=21:9,
若只有氧化亚铁,在FeO中Fe、O元素的质量比为56:16=7:2=21:6,
则7:3<21:8<Fe2O3<7:2,
则反应后固体可能为氧化铁和氧化亚铁的混合物,也可能为氧化铁、氧化亚铁、四氧化三铁的混合物,
所以答案是:Fe2O3和FeO;Fe3O4、Fe2O3和FeO.
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题. 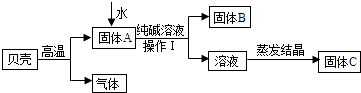
(1)贝壳高温煅烧时,发生反应的化学方程式是;
(2)操作Ⅰ中用到的玻璃仪器有烧杯、、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是;
(4)【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗? 【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH
乙:NaOH和Na2CO3的混合物
丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
实验操作 | 现象 | 结论 | |
甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 | 无气泡产生 | 猜想不成立 |
丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液 | 猜想成立 |
【反思与评价】同学们认真研究实验流程,讨论后一致认为乙、丙两同学的方案、现象和推理均正确,请你根据实验流程对甲同学设计的方案进行合理的评价: .
【题目】固体酒精因方便、安全而受到野外用餐者的喜爱.其制作主要过程如下:将醋酸钙溶液溶于适量水配制成饱和溶液,向该溶液中慢慢加入酒精,揽匀,即制得固体酒精.0℃~60℃时,醋酸钙的溶解度随着温度的升高而减小(见下表):
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度(g) | 37.4 | 36 | 34.7 | 33.8 | 33.2 | X | 32.7 |
(1)将醋酸钙不饱和溶液变为饱和溶液的方法是:加入醋酸钙、或;
(2)10℃时,要配制68g醋酸钙饱和溶液,需无水醋酸钙g;
(3)利用表中数据确定x值的方法是 .