��Ŀ����
�Ȼ�����һ����Ҫ�Ļ���ԭ�ϡ�����Ȼ�����Һ���Ƶ��������������Ƶ����ʣ������Ļ�ѧ��ӦΪ��2NaCl+2H2Oͨ��Cl2+H2��+2NaOH
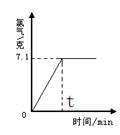
��ȡһ����������������Ϊ10%��NaCl��Һ���е�⣬���Ȼ�����ȫ��Ӧʱ��ֹͣͨ�磬����������������ʱ��Ĺ�ϵ��27ͼ��ʾ������㣺
��1���μӷ�Ӧ���Ȼ����Ƕ��ٿˣ������������٣�
��2����ȫ��Ӧ��������Һ�����ʵ����������Ƕ��٣�
�⣺��xgNaCl�μӷ�Ӧ������H2yg��NaOHzg
2NaCl+2H2O![]() Cl2+H2��+2NaOH (1��)
Cl2+H2��+2NaOH (1��)
117 71 2 80
x 7.1g y z
117:71=x:7.1g x=11.7g (2��)
71:2=7.1g:y y=0.2g (2��)
71:80=7.1:z z=8g (2��)
�Ȼ�����Һ����Ϊ��11.7g/10%=117g
��ȫ��Ӧ��NaOH��Һ��NaOH����������Ϊ
[8g/(117g-7.1g-0.2g)]��100%=7.3% (1��)

��ϰ��ϵ�д�
 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д� ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
�����Ŀ
 ��2013?������һģ����Ԫ�ض��������������������Ҫ���壮
��2013?������һģ����Ԫ�ض��������������������Ҫ���壮
 ��Ԫ�ض��������������������Ҫ���壮
��Ԫ�ض��������������������Ҫ���壮
