题目内容
【题目】某化学课堂围绕"酸碱中和反应",将学生分成若干小组,在老师引导下开展探究活动,以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
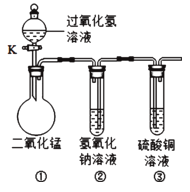
(1)在实验室配制所需的稀硫酸和氢氧化钠溶液配制稀硫酸时需将浓硫酸稀释正确操作是______________;在称量氢氧化钠固体时应将药品放在___________中称量。
【演示实验】将一定量的稀H2SO4加人到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式___________。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4,猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是_____。
【实验探究】(2)丙组同学取烧杯中的溶液少量于试管中滴加几滴CuSO4溶液,无明显
变化,溶液中一定没有_____________________。
(3)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的PH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
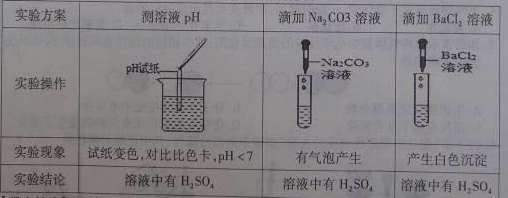
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】(2)中存在两处明显错误,请大家反思,同学们经过反思发现了这两处错误。
①实验操作中的错误是_____________。
②实验方案中也有一个是错误的,错误的原因是_____________________。
(4)98克质量分数为20%的稀硫酸与102克氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数__________。
【答案】 将浓硫酸沿器壁慢慢注入水中,并不断搅拌 小烧杯 2NaOH+H2SO4=Na2SO4+2H2O 猜想四 NaOH 直接将PH试纸伸入待测液中 BaCl2也能与Na2SO4反应生成白色沉淀 14.2%
【解析】(1)浓硫酸密度比空气密度大,稀释时放出大量的热,将水加入浓硫酸中后,会产生危险,氢氧化钠极易潮解,故为:把浓硫酸沿器壁慢慢注入水里,并不断搅拌,小烧杯中;
【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,化学方程式为H2SO4+2NaOH═Na2SO4 +2H2O;
【假设猜想】硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量,但不能同时过量,因为酸碱不能共存,会继续反应,故猜想四不合理;
【实验探究】(2)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠;
(3)碳酸钠和硫酸反应能生成二氧化碳气体,会看到溶液中有气泡冒出;
【评价反思】①根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
②检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸。
(4)设反应后,生成硫酸钠的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
98 142
98g×20% x
![]()
x=28.4g
反应后所得溶液中溶质的质量分数为![]() ×100%=14.2%,
×100%=14.2%,
答:反应后所得溶液中溶质的质量分数为14.2%。