��Ŀ����
����Ŀ����ͼ�dz������ʵ�ת����ϵ������X��Ũ��Һ�ܻӷ����ݼ�����ζ�����壬A��D �ķ�Ӧ����������ɫ�������ɣ�EΪ��ɫ���������ַ�Ӧ������P��Ӧ������ʡ�ԡ�
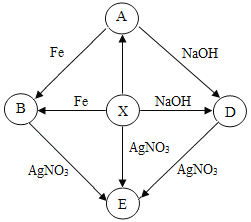
��1��B�Ļ�ѧʽΪ_____��
��2��д��X��D�Ļ�ѧ����ʽ_____��
��3��E�Ļ�ѧʽΪ_____��X��AgNO3��Ӧ��������Һ��pH_____7��ѡ����ڡ�С�ڻ��ڡ�����
��4��A��Һ�����۳�ַ�Ӧ��ȡʣ�����������ᣬû������ų�����A�����۷�Ӧ�����Һ����г��� H2O������B�⣬�����ܴ��ڵ�������_____��д��ѧʽ����
���𰸡�FeCl2 NaOH+HCl=NaCl+H2O AgCl �� CuCl2
��������
����A��G�dz��л�ѧ�������ʣ�X��Ũ��Һ�ܻӷ����̼�����ζ�����壬X�����ۡ��������ƻᷴӦ������X�����ᡣ��A��D�ķ�Ӧ����������ɫ�������ɣ����ݸ��ֽⷴӦԭ����֪A�к���ͭ���ӣ�A����ͭ�Σ���A������X����ת����������A���Ȼ�ͭ���Ȼ�ͭ���������Ʒ�Ӧ������ɫ��������ͭ�������Ȼ��ƣ�������������Ʒ�ӦҲ�������Ȼ��ƺ�ˮ������D���Ȼ��ơ��Ȼ�ͭ�����۷�Ӧ�������Ȼ�������ͭ�����������Ӧ�������Ȼ�����������������B���Ȼ�������EΪ��ɫ������X��B��D�ж����������ӣ�����������Ӧ�����ɰ�ɫ����������E���Ȼ�����
��1�����ݷ�����֪��B�������Ȼ��������ʴ�Ϊ��FeCl2��
��2�����ݷ�����֪��X��D�ķ�Ӧ��������������Ʒ�ӦҲ�������Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪNaOH+HCl=NaCl+H2O���ʴ�Ϊ��NaOH+HCl=NaCl+H2O��
��3�����ݷ�����E�Ļ�ѧʽΪ AgCl��X��AgNO3��Ӧ����ϡ��������������Һ��Ӧ�����Ȼ���������ϡ���ᣬ���������ԣ��ʷ�Ӧ��������Һ��pH��7���ʴ�Ϊ��AgCl������
��4��ͨ���Ƶ���֪A���Ȼ�ͭ���Ȼ�ͭ��Һ�����۷�Ӧ��ȡʣ�����������ᣬû������ų���˵����Ӧ��Ĺ�����û�����ۣ����ۿ��ܸպ����Ȼ�ͭ��Ӧ����ʱ��Һ�е��������Ȼ��������п������۲��㣬û�����Ȼ�ͭ��ȫ��Ӧ����ʱ��Ӧ����������Ȼ��������Ȼ�ͭ������A�����۷�Ӧ�����Һ����г���H2O�⣬һ�����ڵ�������FeCl2�����ܴ��ڵ�������CuCl2���ʴ�Ϊ��CuCl2��

 ��У����ϵ�д�
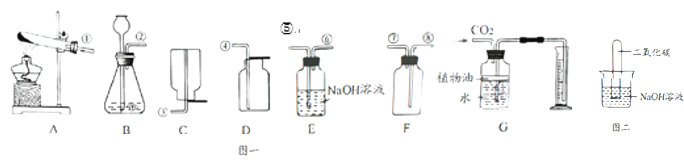
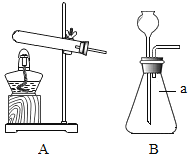
��У����ϵ�д�����Ŀ����1������ͼʾʵ��װ�ã��ش��������⡣
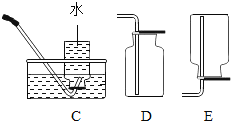
��ʵ�����ø��������ȡ����������װ��Ӧѡ������װ����___________�����ţ������ù���������Һ��ȡ�����������װ�ú���������˳��Ϊ������װ����C��___________�����ţ�������װ��ʱ������װ�õij�����Ӧ��װ��C��_____________������a������b������������
��ʵ����ʹ��Bװ����ȡ������̼��ͻ���ŵ���____________�����ƵõĶ�����̼ͨ����ɫʯ����Һ�У��۲쵽��������_____________��
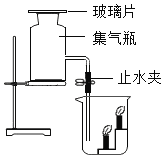
��2��ij��ѧ��ȤС����ʯ��ʯ��������ȡһƿCO2������������ʯ��ˮ���뼯��ƿ�У�����û�б���ǡ���ȤС�������쳣���������̽����
��������⣩����ʯ��ˮΪʲôû�б���ǣ�
����������]��CO2����ʱ��CaCO3������ת��Ϊ������ˮ��Ca��HCO3��2��
��AgCl������ϡ����
��������룩I.ʯ��ˮ����ȫ���� ��_______.��.CO2�л���HCl
��ʵ�鷽������ȤС����ԭҩƷ������ȡCO2��������̽����
�Ʊ�CO2�Ļ�ѧ����ʽΪ___________��
ʵ�鲽�� | ʵ������ | ʵ����� |
1.ȡ��������ʯ��ˮ���Թ��У�����________��Һ�� | ������ɫ���� | ����I������ |
2.����������ͨ��ʢ�г���ʯ��ˮ���Թ��� | __________ | ������������ |
3.____________ | ______________ | ���������� |
����Ŀ����1��������ͼ��ʵ��װ�ã��ش����⣺
����װ�� | �ռ�װ�� | ϴ��װ�� |
|
|
|
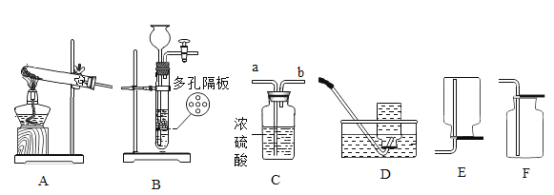
��ͼB������a������_____��
��ʵ�����ü�������غͶ������̻������ȡ�����Ļ�ѧ����ʽΪ��_____���������ռ�װ��Ϊ_____������ĸ����
��ʵ������ʯ��ʯ��ϡ���ᷴӦ��ȡ������̼�����г����������Ȼ������壬��ͨ��ʢ�б���̼��������Һ��Fװ������ȥ����������Ӧ��Fװ�õ�_____�˿ڣ���١��ڡ���ͨ�룬F�з����Ļ�ѧ����ʽΪ_____��
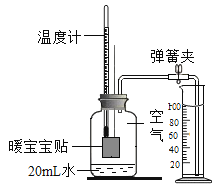
��2��Ϊ��̽��������ʣ�������ͼ��ʾ��ʵ�顣

��ͼ����ʾ������һ�������������Һ�ɺ�ɫ��Ϊ����ɫ��֤���������NaOH�������кͷ�Ӧ���ҷ�Ӧ�����Һ��һ��û�е�������_____�������Լ�ʵ��������Һ�����ʳɷֲ�������Ȥ���Է�Ӧ����Һ��Ϊ��ɫ������������ֲ��룺
����1�����ʳɷ�ֻ��NaCl��
����2�����ʳɷ�Ϊ_____��
������ʵ�飩Ϊ����֤�Լ��IJ�����ȷ����������������ʵ�飬�������һ���������ʵ�鱨�棺
ʵ����� | ʵ������ | ʵ����� |
ȡ������ʵ��������Һ���Թ��У������Թ��м���_____ | �۲쵽_____ | ����2��ȷ |
����ͼ�Һͱ���ʾ��ͬʱ����֧����CO2����ͬ�Թֱܷ��ڵ������ˮ��NaOH��Һ�У�һ��ʱ�������Թ���Һ������ҡ�˵��NaOH��CO2�����˷�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ_____����ʵ�����ҵ�������_____��