题目内容
【题目】根据如表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)40℃时,100g水中最多溶解NaCl______ g
(2)A是80℃含有120g水的KNO3溶液,经过如下操作,A经恒温蒸发得到B,B经降温至200C得到C,过滤后得到102gKNO3固体。流程如下图所示。
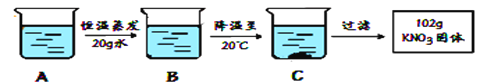
①A溶液为________(选填“饱和”或“不饱和”)溶液
②对以下过程的分析,正确的是_________(选填编号)
a.A到B的过程中,溶质质量没有改变 b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等于222g d.开始析出KNO3固体的温度在60℃至80℃之间
【答案】36.6 不饱和 ad
【解析】
(1)固体溶解度表示在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,由题表知40摄氏度时,氯化钠的溶解度是36.6g,表示40摄氏度时,100g水中最多溶解36.6g氯化钠,溶液就达到饱和状态了,故填36.6;
(2)
①故填不饱和;
②溶液A恒温蒸发20g水后得到的B溶液中没有析出晶体,可以判断A为不饱和溶液,故填不饱和;
a、蒸发20g水后,溶剂质量变为100g,没有晶体析出,所以溶质质量没有改变,选项正确;
b、由题表知20℃时KNO3的溶解度是31.6g,所以溶液C中的溶质质量为31.6g,由此可知80℃时A溶液中含有的溶质质量是31.6g+102g=133.6g,溶液B中溶质与溶剂的质量比为133.6g∶100g=167∶125,选项不正确;
c、由上分析可知A溶液的质量等于133.6g+120g=253.6g,选项不正确;
d、硝酸钾在80℃时的溶解度是169g,在60℃时的溶解度是110g,所以开始析出KNO3固体的温度在60℃至80℃之间,选项正确;故填ad。