题目内容
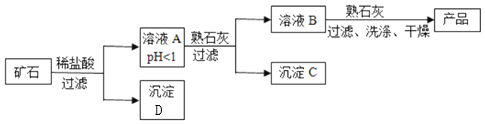
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示![]() 已知:二氧化硅不溶于水也不与稀盐酸反应
已知:二氧化硅不溶于水也不与稀盐酸反应![]() 。
。
请回答下列问题:
![]() 溶液A中共含有______种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______
溶液A中共含有______种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______![]() 只写一个
只写一个![]() 。
。
![]() 在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围是______。
在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围是______。
氢氧化物 |
|
|
|
开始沉淀的pH |
|
|
|
完全沉淀的pH |
|
|
|
![]() 写出沉淀D的化学式______,从物质分类看它属于______
写出沉淀D的化学式______,从物质分类看它属于______![]() 选填“单质”“氧化物”“酸”“碱”“盐”
选填“单质”“氧化物”“酸”“碱”“盐”![]()
![]() 写出溶液B中加入熟石灰发生的化学反应方程式______。
写出溶液B中加入熟石灰发生的化学反应方程式______。
【答案】4 ![]()
![]()
![]() 氧化物
氧化物 ![]()
【解析】
![]() 溶液A中含有的阳离子有镁离子、铁离子、铜离子和氢离子;
溶液A中含有的阳离子有镁离子、铁离子、铜离子和氢离子;
氧化镁和稀盐酸反应生成氯化镁和水,氧化铁和稀盐酸反应生成氯化铁和水,氧化铜和稀盐酸反应生成氯化铜和水,化学方程式为:![]() ,
,![]() ,
,![]() ;
;
![]() 由表中数据可知,溶液B的pH控制在
由表中数据可知,溶液B的pH控制在![]() 时,铁离子、铜离子分别以氢氧化铁、氢氧化铜沉淀析出,而镁离子仍然在溶液中;
时,铁离子、铜离子分别以氢氧化铁、氢氧化铜沉淀析出,而镁离子仍然在溶液中;
![]() 二氧化硅不会与盐酸反应,所以沉淀D的化学式是
二氧化硅不会与盐酸反应,所以沉淀D的化学式是![]() ,从物质分类看它属于氧化物;
,从物质分类看它属于氧化物;
![]() 氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,化学方程式为:
氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,化学方程式为:![]() 。
。

【题目】1941年,侯德榜(如图)向氨水(NH3·H2O)中通入足量的二氧化碳,再向所得的溶液中加入NaCl使其溶解,结果发现在常温下析出一种白色固体。

[提出问题]析出的白色固体是什么?
[进行猜想]①NH4Cl;②(NH4)2CO3;③NH4HCO3;④Na2CO3;⑤NaHCO3
[收集证据]佐证一:设计实验,检验析出的白色固体是上述猜想中的哪一种物质?首先向白色固体中滴加氢氧化钠溶液,并微热,没有察觉到(1)___________现象,说明不是铵盐。
当检验是哪种钠盐时,做对比实验。取过量的碳酸钠、碳酸氢钠和析出的白色粉末三种物质,分别装在相同的三个气球中,再将瘪气球系紧在装有等量的盐酸的试管口上,并做如下实验(如图)

B和C产生的气体体积相等,该气体是(2)_______,则侯德榜实验中,析出的白色粉末的是(3)_________。
佐证二:查找上述五种物质在常温下的溶解度资料是:
①NH4Cl | ②(NH4)2CO3 | ③NH4HCO3 | ④Na2CO3 | ⑤NaHCO3 |
37.2g | 100g | 21.7g | 21.5g | 9.6g |
通过溶解度分析判断,析出的白色固体与上述实验判断的物质相同。
[反思交流] 1.通过溶解度判断析出的物质也是(3)的结论,理由是(4)______________;
2.在化肥中没有碳酸铵,原因之一是碳酸铵在空气中,吸收某些成分会变成碳酸氢铵。反应方程式为(5)_____。
3.侯德榜实验析出一种白色固体,过滤出固体,得到滤液。要检验滤液中含有Cl—和CO32—,你检验的方法是 (6)________。