题目内容
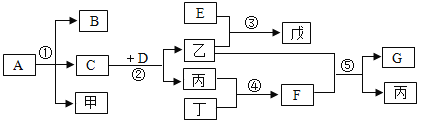
【题目】如图所示实验设计不能达到目的的是( )
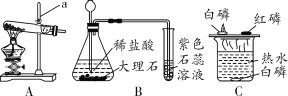
A.除去氢气中的氯化氢气体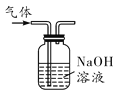
B.鉴别NH4NO3、CuSO4和NaCl三种白色粉末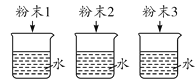
C.检验酸性强弱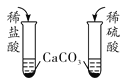
D.除去CO中的CO2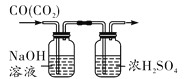
【答案】C
【解析】
氢气中的氯化氢气体可以与NaOH溶液反应而被除去,A正确;NH4NO3溶于水溶液温度降低,CuSO4溶于水溶液显蓝色,NaCl溶于水无明显现象,可以鉴别,B正确;稀硫酸与CaCO3反应生成的CaSO4微溶,覆盖在CaCO3的表面阻止反应的进行,所以不能用与CaCO3反应的方法检验HCl与H2SO4的酸性强弱,检验酸性强弱应用pH试纸,C错误;CO不与NaOH溶液反应,故可将CO2与CO的混合气体通入NaOH溶液从而除去CO2,通过浓硫酸干燥后得到CO,D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
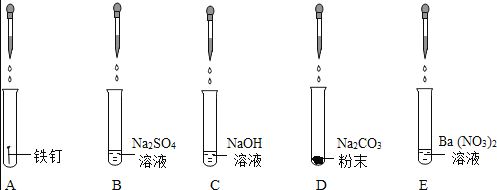
目标测试系列答案【题目】科学探究是学习化学重要而有效的学习方法。某校化学兴趣小组的同学以“酸碱中和反应”为课题进行探究。小宇同学向烧杯中的氢氧化钠溶液中滴加稀硫酸,一会儿后发现忘了滴加酸碱指示剂,于是他停止滴加稀硫酸。同学们纷纷对实验后烧杯中溶液中含有哪些溶质展开了讨论。
(提出问题)实验后的烧杯中溶质含有哪些物质?
(提出猜想)猜想一:溶质中只有Na2SO4;
猜想二:溶质中可能是Na2SO4和NaOH;
猜想三:溶质中可能是_____。
(查阅资料)Na2SO4溶液呈中性。
(实验探究)小宇同学设计如下的实验方案
方法步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,滴入几滴无色酚酞溶液 | 溶液不变红色 | 猜想一正确 猜想二不正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,滴加BaCl2溶液 | 出现白色沉淀 | 猜想三正确 |
方案三 | 取少量烧杯中的溶液于洁净的试管中,加入少量的黑色CuO粉末,振荡 | _____ | 猜想三正确 |
(方案评价)同学们对小宇上述的方案讨论后认为:
①方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是_____。
②方案二也不能证明猜想三是正确的,理由是_____。
③同学们经过讨论,一致认为方案三能够证明猜想三是正确的,并讨论除此方案外,还可以向烧杯的溶液中加入活泼金属、碳酸盐等物质进行证明。
(实验反思)在分析化学反应后所得物质成分时,还需考虑反应物的用量。
(学科渗透)如图1所示,小宇同学在进行溶液导电性的实验时,将电极两端插入稀H2SO4中。闭合开关,小灯泡正常发光,然后逐滴向稀H2SO4中加入Ba(OH)2溶液至过量,请推测小灯泡的发光情况为_____;发生反应的化学方程式是_____。

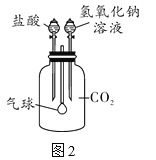
(反思应用)利用如图2所示装置来验证CO2气体的性质,要证明CO2与NaOH溶液能够发生反应,可先加氢氧化钠溶液,再加盐酸,气球的变化是_____。
(方法感悟)在化学实验中,可通过验证反应后生成物的存在,来验证某化学反应的发生。