题目内容
【题目】下表列出了除去物质中所含少量杂质的方法,其中不正确的是
选项 | 物质 | 所含杂质 | 除去杂质的方法 |
A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
B | CaO | CaCO3 | 加水溶解、过滤 |
C | NaOH | Na2CO3 | 加适量的Ca(OH)2溶液、过滤 |
D | FeCl2 | CuCl2 | 加入过量的铁粉,充分反应后过滤 |
【答案】B
【解析】
试题分析:B中氧化钙会和水发生反应,而碳酸钙不能和水反应也不能溶于水中。故选B.

 应用题作业本系列答案
应用题作业本系列答案【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁元素的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2 反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O![]() CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。
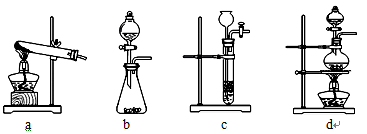
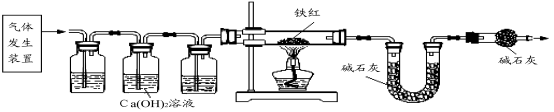
【问题讨论】用下图所示装置进行实验:
A B C D E F
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 、 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式 。
(5)B装置的作用是 。
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前 。 ②停止加热后 。
(7)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(8)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
① D中充分反应后得到Fe粉的质量为m g,则 < m < 。
② 实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 。
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会 (填“偏小”、“不变”或“偏大”)。
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 。