题目内容
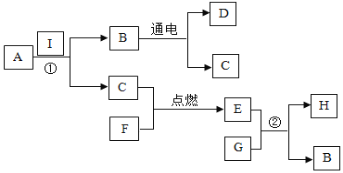
【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如下:
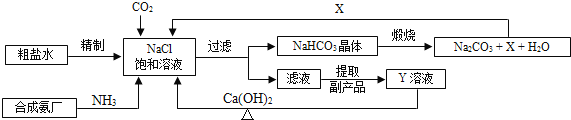
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序为 ________、盐酸(只写一种).加盐酸的作用是(用化学方程式表示) ___________、 _________.
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则该反应类型为 __________.
(3)X的化学式为 ___________.
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 _______,Y的化学式 __________,写出Y的一种用途 ____________.
【答案】NaOH溶液、BaCl2溶液、Na2CO3溶液 NaOH+HCl═NaCl+H2O Na2CO3+2HCl═2NaCl+H2O+CO2↑ 复分解反应 CO2 氨气 NH4Cl 用作氮肥.
【解析】
加入稍过量的NaOH溶液可以将Mg2+转化氢氧化镁沉淀,加入稍过量的Na2CO3溶液可以将Ca2+转化为碳酸钙沉淀除去,加入稍过量的BaCl2溶液可以将SO42-转化为硫酸钡沉淀除去SO42-;为除去稍过量的BaCl2溶液对后续实验的干扰,可用稍过量的Na2CO3溶液除去BaCl2溶液,则加入试剂合理的顺序为NaOH溶液、BaCl2溶液、Na2CO3溶液,故填NaOH溶液、BaCl2溶液、Na2CO3溶液;
(1)利用盐酸可以除去过量的氢氧化钠,故反应的化学方程式写为:NaOH+HCl═NaCl+H2O;
利用盐酸可以除去过量碳酸钠溶液,故反应的化学方程式写为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
(2)由反应②是盐与盐反应生成两种新盐可知,反应属于复分解反应,故填复分解反应。
(3)由碳酸氢钠受热生成碳酸钠、二氧化碳和水可知,X是二氧化碳,其化学式为CO2,故填CO2。
(4)由流程图可知Y为氯化铵,其能与氢氧化钙反应生成可以循环使用的氨气,故填氨气;
Y为氯化铵,其化学式为NH4Cl,故填NH4Cl;
氯化铵是一种铵盐,可以用在农业上的氮肥,故填用作氮肥。

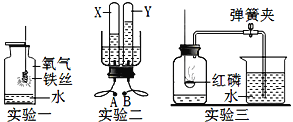
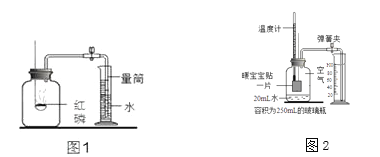
【题目】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图1),
写出红磷燃烧的化学方程式____。打开止水夹后,水能进入集气瓶中的原因是______。
(提出问题)某兴趣小组用该方法测出的氧气含量常常远低于21%。为什么?
(进行猜想)(1)装置漏气;(2)________(3)反应后未冷却到室温……
在老师的指导下,小组同学在装置气密性能良好、操作规范的情况下,重复图1实验,测定结果低于20%,用测氧气浓度的传感器测得反应后装置内氧气浓度为8.85%.
(查阅资料):燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大。
(实验探究)再次测定空气中氧气含量。
该小组同学根据铁在空气中生锈的原理设计图2实验装置。
Ⅰ.同学们采用了“暖宝宝”做实验,暖宝宝中含有铁粉、活性炭、水、氯化钠等物质。装置中饱和食盐水会加速铁生锈。
铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁。
工业上用一氧化碳还原赤铁矿(主要成分氧化铁),写出该反应的化学方程式: ______。
Ⅱ.8分钟后测得的实验数据如下表。根据如表数据计算,改进实验后测得的空气中氧气的体积分数是 ________。(写出数据表达式即可)
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物) 和导管的容积 | |
体积/mL | 100.0 | 74.5 | 126.0 |
(结论)该测定方法,装置内残留的氧气更少,实验结果更准确。
(拓展)小组中某同学认为实验后的暖宝宝贴中仍含有铁粉,才能说明该结果接近精确值。
请你设计实验证明反应后的暖宝宝中仍有铁单质存在__________。