题目内容
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂。
资料:Ⅰ.金属钙的活动性很强,遇水立刻剧烈反应生成氢氧化钙,并产生一种气体。
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气。
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙。
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝。
Ⅴ.碱石灰是固体氢氧化钠和氧化钙的混合物,碱石灰和无水氯化钙都可以吸收水分。
①对于“金属钙与水反应生成的气体”有如下猜想:甲:氧气,乙:氢气
你支持_____(填“甲”、“乙”)观点,理由是依据_____定律。
②写出CaH2与水反应的化学方程式_____。
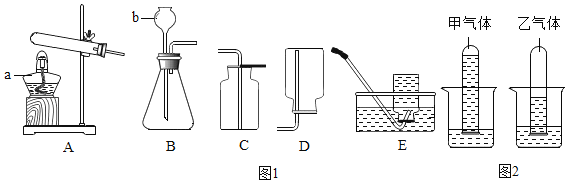
③实验室可用氢气与金属钙加热可得到氢化钙,如图是反应装置图。
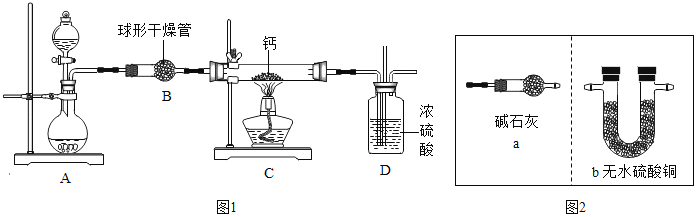
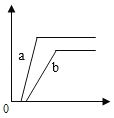
装置B 中装有无水氯化钙,其作用是_____,若要证明进入C 装置中的氢气已经干燥,则应该在B、C之间连接右图中的哪个装置:_____(填a或b),现象是_____。
④制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,向溶液中滴入酚酞后显红色。该同学据此判断:上述实验确实有CaH2生成。你认为该结论是否正确_____(填“是”或“否”),原因是_____。
【答案】乙 质量守恒 CaH2+2H2O═Ca(OH)2+2H2↑ 除去氢气中混有的水蒸气 b 无水硫酸铜不变蓝,说明氢气已经干燥 否 因为金属钙与水反应会生成氢氧化钙和氢气,也能呈现相同的现象
【解析】
氢化钙和水反应生成氢氧化钙和氢气,无水硫酸铜遇水变蓝,钙与水反应生成氢氧化钙和氢气,氢气和钙加入生成氢化钙。
①由于金属钙与水反应生成的气体中的氢元素或氧元素都存在与反应物水中,水中氢原子和氧原子的个数比为2:1,所以生成气体只能是氢气;钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2:1,反应后会大于2:1);故乙的观点正确;反应前后质量守恒。
②CaH2与水反应的反应物是CaH2和H2O,生成物是Ca(OH) 2和H2;化学方程式为
![]() 。
。
③无水氯化钙可以吸收水蒸气,所以B装置中无水氯化钙的作用是除去氢气中混有的水蒸气;因为无水硫酸铜遇水变蓝,所以在BC之间加入b装置,如果无水硫酸铜遇水变蓝说明水蒸气没被除尽,如果不变蓝说明水蒸气被除尽。
④观察到有气泡冒出,在溶液中滴入酚酞后显红色,上述实验确有CaH2生成,是错误的,因为钙与水反应也生成氢氧化钙和氢气,现象与氢化钙与水反应的现象相同。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案