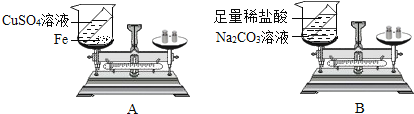
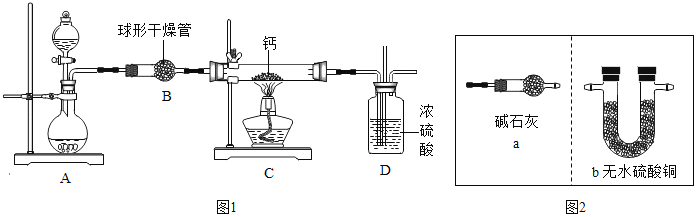
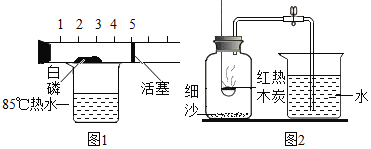
题目内容
【题目】物质由微粒构成,其中奥秘知多少。
(1)如图是前20号常见某些元素和粒子的相关信息,请完成下列内容。
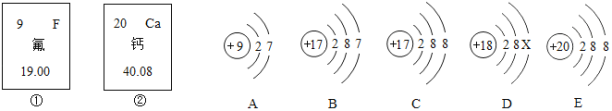
(1)图中涉及到的元素种类有_____种;X=_____;
(2)请写出E粒子的符号_____;
(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似_____ (填序号)。
【答案】四 8 Ca2+ B
【解析】
决定元素的化学性质的是原子的最外层电子数,最外层电子数相同,化学性质相似。
(1)由粒子结构示意图,其核内质子数分别是9、17、18、20,分别是氟、氯、氩、钙元素,图中涉及到的元素种类有氟、氯、氩、钙四种,当质子数=核外电子数时为原子,
![]() ,X=8。
,X=8。
(2)E粒子质子数为20,核外电子数为18,质子数>核外电子数,为带2个单位正电荷的钙离子,其离子符号为Ca2+。
(3)决定元素的化学性质的是原子的最外层电子数,A原子B原子的最外层电子数相同,A原子的化学性质与B原子的化学性质相似。

【题目】小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
(实验探究)稀盐酸与氢氧化钠反应的化学方程式为_____。
(提出猜想)所得溶液可能呈碱性,也可能呈_____性,还可能呈_____性。
(实验验证)
实验操作 | 实验现象 | 结论 |
用试管取该溶液1﹣2mL,滴入 1﹣2滴无色酚酞试液,振荡 | 无色酚酞试液变_____ | 溶液呈碱性 |
无色酚酞试液不变色 | 溶液呈_____ |
若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为_____;若无明显现象,则溶液呈_____性。
(分析论证)如图是小亮同学根据实验绘制的溶液的pH随加入溶液的质量变化的曲线。
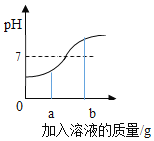
①氢氧化钠与盐酸恰好完完全反应时,溶液的pH_____7(填“>“<”或“=”)
②根据曲线判断,小亮是将_____(填“氢氧化钠溶液”或“盐酸”,下同)滴入_____中。
③当滴入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液颜色为_____色,此时溶液中的溶质是_____、_____。