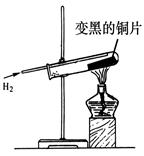
题目内容
某化学兴趣小组的同学选定稀硫酸和氢氧化钡溶液做中和反应实验。在烧杯中加入一定量的氢氧化钡溶液后滴入几滴酚酞试液,再向烧杯中加入一定量的稀硫酸。用玻璃棒充分搅拌后过滤,得白色沉淀和无色液体。
【提出问题】无色液体是什么物质?(不考虑指示剂)
【猜想】小明:无色液体是水;小岩:无色液体是Ba(OH)2溶液;小丽认为无色液体可能是 溶液。
【实验探究】(1)如果你是小组成员之一,你认为小明猜想的理由是
(2)你认为小岩的猜想 。(“正确”或“不正确”)。理由是
。
(3)填写小丽的猜想,并针对她的猜想,请你设计实验验证是否正确。
【拓展应用】(4)请举例说明中和反应在生产生活中的应用:
【提出问题】无色液体是什么物质?(不考虑指示剂)
【猜想】小明:无色液体是水;小岩:无色液体是Ba(OH)2溶液;小丽认为无色液体可能是 溶液。
【实验探究】(1)如果你是小组成员之一,你认为小明猜想的理由是
(2)你认为小岩的猜想 。(“正确”或“不正确”)。理由是
。
(3)填写小丽的猜想,并针对她的猜想,请你设计实验验证是否正确。
| 实验步骤 | 实验现象及结论 |
| | |
【猜想】稀硫酸
(1)稀硫酸和氢氧化钡溶液恰好完全反应。(2)不正确,氢氧化钡溶液能使酚酞溶液变红。
(3)设计实验(答案合理均给分)
(4)(答案合理均给分)
(1)稀硫酸和氢氧化钡溶液恰好完全反应。(2)不正确,氢氧化钡溶液能使酚酞溶液变红。
(3)设计实验(答案合理均给分)
| 实验步骤 | 实验现象及结论 |
| 取少量无色溶液于试管中,滴入几滴紫色石蕊溶液。 | 若溶液变红,则小丽的猜想正确. 若溶液不变红,则小丽的猜想不正确 |
试题分析:【猜想】根据题意,参加反应的物质是氢氧化钡和稀硫酸,二者反应生成硫酸钡沉淀和水,故若二者恰好完全反应,则无色液体是水;若不完全反应,则反应物有剩余,故无色液体可能是氢氧化钡溶液,还可能是稀硫酸。
【实验探究】(1)根据上面的分析可知,当氢氧化钡与硫酸恰好完全反应时,生成硫酸钡沉淀和水,且水不能使加入的酚酞变色,故小明猜测是水,正确。
(2)由于酚酞试液遇碱性溶液变红色,故无色液体不可能是氢氧化钡溶液,错误。
(3)根据小丽的猜想是稀硫酸可知,要检验是否存在硫酸,可以依据硫酸的性质进行设计实验验证,如取少量无色溶液于试管中,并向其中滴入几滴紫色石蕊溶液,若溶液变红,则小丽的猜想正确,若溶液不变红,则小丽的猜想不正确;或取少量无色溶液于试管中,并向其中滴入几滴碳酸钠溶液,观察是否有气泡产生,若有气泡产生,则小丽的猜想正确,若无气泡产生,则小丽的猜想不正确,等等。
【拓展应用】(4)中和反应在生产生活中的应用有很多,如中和反应还可以应用于改良酸性土壤,处理酸碱性废水等。
点评:理解和熟练掌握中和反应的原理及其应用,是解答本题的关键;另外,对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
相关题目
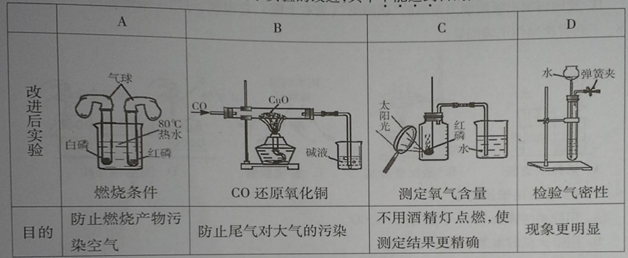
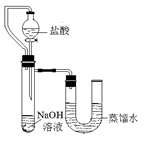
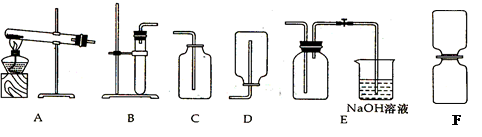
 Na2CO3↑+CO2 ↑+H2O ;
Na2CO3↑+CO2 ↑+H2O ;