题目内容
【题目】(4分)已知碳酸氢钠加热能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解。现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,取4.0g 样品加热到质量不再减少时,共收集到二氧化碳气体0.88g。
(1)写出碳酸氢钠受热分解的化学方程式 。
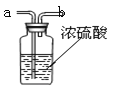
(2)要得到干燥的二氧化碳气体,下图中盛放能吸水的浓硫酸,
生成的气体应从 (选填“a”或“b”)端导入。
(3)求该样品中碳酸钠的质量分数。(写出计算过程)
【答案】(1)2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(2)a (3)16%
【解析】
试题分析:
(1)根据题意可知:碳酸氢钠加热能分解为碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3△Na2CO3+H2O+CO2↑。
(2)要达到干燥的效果,生成的气体应从长管进入,从短管中导出,所以应从a端导入。
(3)根据题意可知,已知量为二氧化碳的质量,未知量为该样品中碳酸钠的质量分数。
解题思路:可根据二氧化碳气体的质量,结合碳酸氢钠分解的化学方程式,求出反应的碳酸氢钠的质量,进一步求出未知量。具体解题过程如下:(写出计算过程)
解:设碳酸氢钠的质量为x;
2NaHCO3△Na2CO3+H2O+CO2↑
168 44
x 0.88g
168:44=x:0.88g
x= 3.36g
该样品中碳酸钠的质量分数为:![]() ×100%=16%
×100%=16%
答:该样品中碳酸钠的质量分数为16%

练习册系列答案
相关题目
【题目】将一定量的丙醇(C3 H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
下列判断正确的是 ( )
A.表中a的值为2.8 B.X一定是该反应的催化剂
C.X可能含有氢元素 D.X中含有碳元素和氧元素