题目内容
将10g碳酸钙放入100g稀盐酸中恰好完全反应,
1)求反应后生成物溶液的溶质质量分数?________
2)求原盐酸溶液的浓度.________.
10.5% 7.3%
分析:(1)反应后生成物溶液的溶质是氯化钙,质量可由碳酸钙的质量求得.根据质量守恒定律,反应后溶液质量是反应前总质量减去生成的二氧化碳质量,即(10g+100g)-4.4g=105.6g;
(2)根据碳酸钙的质量可求得盐酸溶液中溶质的质量,进而求出原盐酸溶液的浓度.
解答:设原盐酸溶液的溶质质量为x,生成二氧化碳的质量为y,反应后生成物溶液的溶质为z
CaCO3 +2HCl=CaCl2 +CO2↑+H20
100 73 111 44
10g x z y
 ,
, ,
,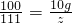
x=7.3g,y=4.4g,z=11.1g
(1)反应后生成物溶液的溶质质量分数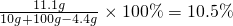
(2)稀盐酸的质量分数为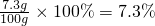
点评:根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算.
分析:(1)反应后生成物溶液的溶质是氯化钙,质量可由碳酸钙的质量求得.根据质量守恒定律,反应后溶液质量是反应前总质量减去生成的二氧化碳质量,即(10g+100g)-4.4g=105.6g;
(2)根据碳酸钙的质量可求得盐酸溶液中溶质的质量,进而求出原盐酸溶液的浓度.
解答:设原盐酸溶液的溶质质量为x,生成二氧化碳的质量为y,反应后生成物溶液的溶质为z
CaCO3 +2HCl=CaCl2 +CO2↑+H20
100 73 111 44
10g x z y
 ,
, ,
,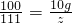
x=7.3g,y=4.4g,z=11.1g
(1)反应后生成物溶液的溶质质量分数
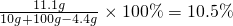
(2)稀盐酸的质量分数为
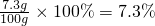
点评:根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算.

练习册系列答案
相关题目
 人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.